الصوديوم Sodium
– هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Na) ، العدد الذري = 11 ، والعدد الكتلي = 23
– التوزيع الإلكتروني له: 1S2 , 2S2 2P6 , 3S1
– هو معدن خفيف ذو لون فضي أبيض ، شديد الفعالية وينتمي إلى عائلة المعادن الأساسية المكونة للمجموعة الأولى في الجدول الدوري للعناصر.

- لين طرياً جداً فى درجة حرارة الغرفة يمكن قطعه بالسكين وله بريق معدني إذا قطع حديثاً ولكنه يفقد بريقه بسرعة.
– يتأكسد (Na) في الهواء، ويتفاعل بشكل عنيف مع الماء أي يجب حفظه في وسط غير مؤكسد.
– يعد الصوديوم ناقلاً جيدا للحرارة.
- من أهم مركبات الصوديوم:
كلوريد الصوديوم (ملح الطعام) NaCl
نترات الصوديوم (ملح باورد شيلي) NaNO3
كربونات الصوديوم Na2CO3
- بيكربونات الصوديوم NaHCO3
الخواص الكيميائية لفلز الصوديوم
- يرجع النشاط الكيميائي العالي للصوديوم إلى سهولة نزع إلكترونه الوحيد الموجود فى (3S) لذا يعتبر عامل مختزل يفقد إلكترون تكافؤه بسهولة.
- يتفاعل مع الأكسجين الموجود فى الهواء بلهب أصفر ساطع مكوناً أكاسيد الصوديوم
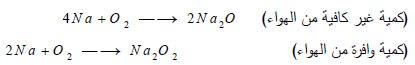
- يتفاعل مع الماء مكوناً هيدروكسيد الصوديوم وغاز الهيدروجين القابل للأشتعال

يكون هذا التفاعل ناشراً للحرارة، حيث تتفاعل القطع الصغيرة منه بشكل سريع مع الماء وتستمر بالتلاشي حتى نهاية التفاعل، في حين يؤدي وجود القطع الكبيرة منه إلى حدوث انفجارات.
- يتفاعل مع اللافلزات بالتسخين

إجابة السؤال بإختصار : لماذا يحفظ الصوديوم تحت سطح الكيروسين؟
- نظراً لنشاطة الكيميائي العالى حيث يتفاعل مع أكسجين الهواء الجوي مشكلاً لهب ويتفاعل بعنف مع الماء مكوناً غاز الهيدروجين القابل للأشتعال. (تكتب المعادلات أعلاه)
- لذا يجب حفظه في وسط غير مؤكسد مثل الكيروسين