تفاعلات الإحلال المزدوج
- يسمى التفاعل الذي يتم فيه تبادل الأيونات بين مركبين تفاعل الإحلال المزدوج.
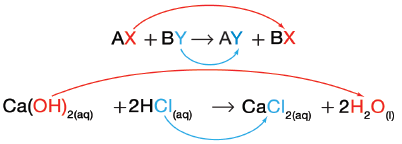
- يمثل الرمزان B , A في هذة المعادلة أيونين موجبين بينما يمثل الرمزان X , Y أيونين سالبين. لاحظ أن الأيونين السالبين قد تبادلا موقعيهما، وصارَا مرتبطين بأيونين موجبين مختلفين.
- بمعنى آخر حل X محل Y ، وحل Y محل X ولهذا السبب يسمى التفاعل تفاعل الإحلال المزدوج.
أمثلة توضيحية
(1) تفاعل هيدروكسيد الكالسيوم وحمض الهيروكلوريك
(Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l
الأيونات في التفاعل هي: -Ca2+ , -OH , H+ , Cl
لاخظ أن الأيونين السالبين: Cl- ، -OH قد غيرا موقعهما ، وارتبطا بالأيونين الموجبين +Ca2+ , H على الترتيب.
(2) تفاعل هيدروكسيد الصوديوم مع كلوريد النحاس II
(2NaOH(aq) + CuCl2(aq) → 2NaCl(aq) + Cu(OH)2(s
لاحظ أن الأيونين السالبين: Cl- ، -OH قد غيرا موقعهما ، وارتبطا بالأيونين الموجبين +Na+ , Cu2 على الترتيب.
- ناتج هذا التفاعل مادة صلبة لا تذوب في الماء وهي هيدروكسيد النحاس II وتسمى المادة الصلبة التى تنتج خلال تفاعل كيميائي في محلول ما راسباً.
السؤال : ما ناتج تفاعل محلول هيدروكسيد الصوديوم مع محلول نترات الامونيوم؟
يتفاعل هيدروكسيد الصوديوم ونترات الأمونيوم وينتج نترات الصوديوم وهيدروكسيد الأمونيوم حسب المعادلة:
(NH4NO3(aq) + NaOH(aq) → NaNO3 (aq)+ NH4OH(aq
ثم ينحل هيدروكسيد الأمونيوم إلى غاز النشادر والماء طبقاُ للمعادلة:
(NH4OH(aq) → NH3(g)↑+ H2O(l
وبجمع المعادلتين السابقتين نحصل على المعادلة الإجمالية التالية:
(NH4NO3(aq) + NaOH(aq) → NaNO3 (aq)+ NH3(g)↑+ H2O(l