الماء متعادل يسلك سلوك الأحماض والقواعد فى التفاعلات الكيميائية
- نجد أن الماء النقي متعادل تكون pH =7
- الماء يسلك سلوك الأحماض والقواعد فى التفاعلات الكيميائية حسب نظرية برونشتد - لوري لذلك فأنه يسمى أمفوتيري أى القدرة على السلوك مرة كحمض ومرة كقاعدة
- في عام 1923 وضع الدنماركي جونز برونشتد والأنجليزى توماس لوري نظريتهما عن الحمض والقاعدة.
- وقد تم تعريف الحمض والقاعدة كالتالي:

وهذا معناه أن يكون اتحاد الحمض والقاعدة هو أن الحمض أى مادة تعطى البروتون والقاعدة هى أى مادة تستقبل البروتون أى أن التفاعل هو انتقال للبروتون من الحمض إلى القاعدة.
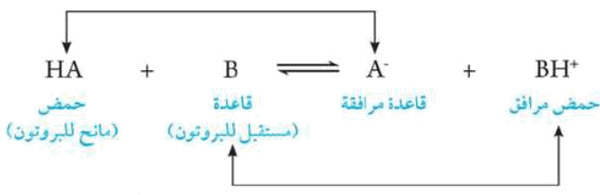
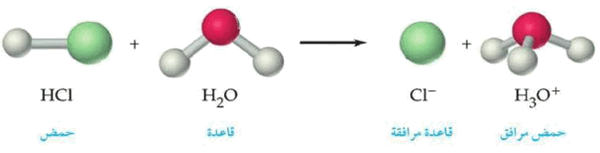
- عند إذابة حمض HCl فى الماء يعتبر HCl حمضاً لأنه يمنح بروتوناً إلى الماء وبالتالي يعتبر الماء قاعدة لأنه يكتسب هذا البروتون ويصبح أيون الكلوريد -Cl قاعدة مرافقة بينما أيون الهيدرونيوم +H3O حمض مرافق.
كما أن التعريف يسمح لنا باعتبار الأمونيا (النشادر) قاعدة والماء حمض كالتالي:

فعندما يمنح الحمض بروتوناً يتحول إلى قاعدة وعندما تكتسب القاعدة هذا البروتون تتحول إلى حمض

الرقم الهيدروجينى للماء
- نجد أن الماء النقي متعادل تكون pH =7
- وقد تنحرف قيمة pH عن 7 نتيجة وجود بعض الشوائب الحامضية فيه فتكون pH < 7 ويسمى الماء الحامضى وقد يحتوى على شوائب قاعدية فتكون pH > 7 ويسمى الماء القاعدي.
- الماء القاعدي صالح للشرب لأنه ينقي الجسم من السموم أما الماء الحامضي صالح للنظافة والزراعة.