أكتب الصيغة الجزيئية لمركب يحتوي على 6g من الكربون ، 1g من الهيدروجين ، و كتلته 42gm/mol؟
الحل:
أولاً/ حساب الصيغة الأولية للمركب
(1) حساب عدد المولات لكل عنصر
عدد المولات لكل عنصر = وزن العنصر فى المركب / الوزن الذري للعنصر
الوزن الذري لعنصرالكربون = 12g/mol
الوزن الذري لعنصر الهيدروجين = 1g/mol
فيكون عدد المولات لكل عنصر كالتالي:
C ⇒ 6 g /12 gmol = 0.5
H ⇒ 1 g / 1 g/mol = 1
(2) نقسم على أقل نسبة من نسب العناصر السابقة
أقل نسبة للعناصر هي 0.5 لذلك نقسم جميع النسب السابقة على 0.544 فيكون:
C ⇒ 0.5 / 0.5 = 1
H ⇒ 1 / 0.5= 2
وعلى ذلك تكون الصيغة الأولية (الصيغة الوضعية) للمركب هي CH2
ثانياً/ حساب الصيغة الجزيئية
الكتلة المولية للصيغة الوضعية CH2
= (2 × 1) + 12 = 14g/mol
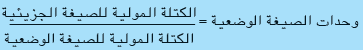
= 42/14= 3
الصيغة الجزيئية = الصيغة الوضعية × وحدات الصيغة الوضعية
الصيغة الجزيئية = 3 × C3H6 = CH2
الصيغة الجزيئية هي C3H6