حرارة الذوبان Heat of solution
- تسمى بحرارة الذوبان Heat of solution أو إنثالبي الذوبان Enthalpy of solution
- يصاحب عملية ذوبان مادة صلبة في سائل ارتفاع أو انخفاض في درجة حرارة المحلول الناتج.
(أ) الذوبان الطارد للحرارة
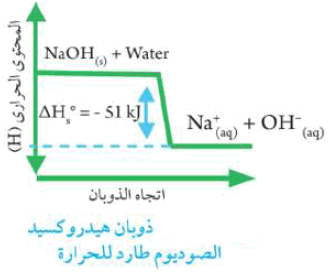
- عند إذابة هيدروكسيد الصوديوم NaOH في الماء ترتفع درجة حرارة المحلول الناتج.
- يسمى الذوبان في هذة الحالة بالذوبان الطارد للحرارة وتكون قيمة حرارة الذوبان ΔHosol له بإشارة سالبة.
- ويعبر عنه بالمعادلة:
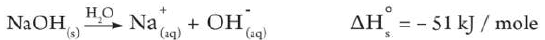
- ويعبر عنه بمخطط الطاقة:
ثانياً/ الذوبان الماص للحرارة
- عند إذابة نترات الأمونيوم NH4NO3 في الماء تنخفض درجة حرارة المحلول الناتج.
- يسمى الذوبان في هذة الحالة بالذوبان الماص للحرارة وتكون قيمة حرارة الذوبان ΔHosol له بإشارة موجبة.
- ويعبر عنه بالمعادلة:
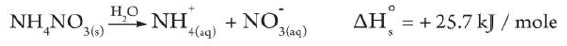
- ويعبر عنه بمخطط الطاقة:

حرارة الذوبان Heat of solution ΔHsol
هي كمية الحرارة المنطلقة أو الممتصة عند إذابة المذاب في كمية من المذيب للحصول على محلول مشبع.
وإذا تم الذوبان في الظروف القياسية تعرف بحرارة الذوبان القياسية ΔHosol
حرارة الذوبان القياسية ΔHosol
هي كمية الحرارة المنطلقة أو الممتصة عند إذابة مول من المذاب في كمية من المذيب للحصول على محلول مشبع فى الظروف القياسية.
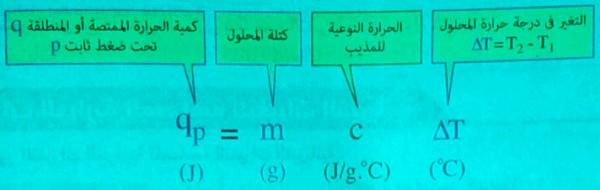
حساب كمية الحرارة (المنطلقة أو الممتصة ) المصاحبة لعملية الذوبان
- تحسب من العلاقة:
- إذا كان حجم المحلول الناتج عن ذوبان مول من المذاب لتراً فان تركيز المحلول يصبح 1 مولر (1mol/L) وتسمى كمية الحرارة المنطلقة أو الممتصة في هذة الحالة بحرارة الذوبان المولارية.
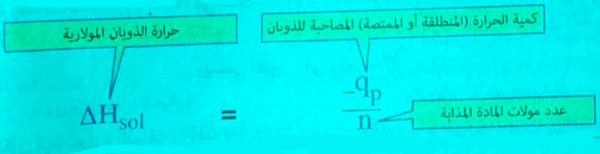
حرارة الذوبان المولارية Molar heat of solution
- هي مقدار التغير الحراري الناتج عن ذوبان مول من المذاب في كمية من المذيب لتكوين لتر من المحلول.
- إذا كانت كمية المادة المذابة لا تساوي 1 مول يمكن حساب حرارة الذوبان المولارية من العلاقة:
تفسير مصدر حرارة الذوبان Heat of solution
- تتأثر عملية الذوبان بثلاث قوى هي:
(1) قوى التجاذب بين جزيئات المذيب وبعضها.
(2) قوى التجاذب بين جزيئات المذاب وبعضها.
(3) قوى التجاذب بين جزيئات المذيب والمذاب.
ولهذا تتم عملية الذوبان على ثلاث خطوات كما يتضح فيما يلي:
(1) فصل جزيئات المذيب عن بعضها
- وهي عملية ماصة للحرارة لامتصاص قدر من الطاقة للتغلب على قوى التجاذب بين جزيئات المذيب وبعضها.
- ويرمز للتغير في المحتوى الحراري لهذة العملية بالرمز ΔH1 بإشارة موجبة
(2) فصل جزيئات المذاب عن بعضها
- وهي عملية ماصة للحرارة لامتصاص قدر من الطاقة للتغلب على قوى التجاذب بين جزيئات المذاب وبعضها.
- ويرمز للتغير في المحتوى الحراري لهذة العملية بالرمز ΔH2 بإشارة موجبة
(3) ارتباط جزيئات المذيب بالمذاب (عملية الإذابة)
- وهى عملية طاردة للحرارة لانطلاق طاقة عند ارتباط جزيئات المذيب بجزيئات المذاب.
- ويرمز للتغير في المحتوى الحراري لهذة العملية بالرمز ΔH3 بإشارة سالبة
ويعرف المجموع الجبري للطاقات الثلاث باسم حرارة ذوبان المحلول ΔHsol
ΔHsol = ΔH1 + ΔH2 +ΔH3
تحديد نوع الذوبان
(1) الذوبان الطارد للحرارة
- في هذة الحالة يكون:
ΔH1 + ΔH2 < ΔH3
- وبالتالي تكون ΔHsol < 0 وبإشارة سالبة ويكون الذوبان طارد للحرارة.

(2) الذوبان الماص للحرارة
- في هذة الحالة يكون:
ΔH1 + ΔH2 > ΔH3
- وبالتالي تكون ΔHsol < 0 وبإشارة موجبة ويكون الذوبان ماص للحرارة.
