حساب المولارية أو العيارية للأحماض والقواعد السائلة
- يتضمن الوعاء الذي يحتوي على المادة معلومات مثل النسبة المئوية للمادة % والكثافة (d) والوزن الجزيئي (M.wt)
ومن خلال هذة المعلومات يمكن حساب العيارية أو المولارية من القوانين الآتية:

سوف نقوم هنا بحساب مولارية المحلول الموجود فى الزجاجة.
- الوزن الجزيئي لحمض الهيدروكلوريك = 1 + 35.5 = 36.5 جم/مول
- النسبة المئوية الوزنية = 37.5%
- الكثافة = 1.19 جم /مول
وقم بالتعويض فى القانون أعلاه :
Molarity = 1.19 * 37.5 *10 / 36.5
12.23M =
مولارية حمض الهيدروكلوريك الموجود معنا هو 12.23M
والمطلوب تحضير 500 مل HCl تركيز 1M من المحلول HCl الذي تركيزه 12.23M لذلك نستخدم قانون التخفيف
قانون التخفيف
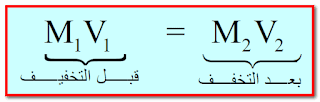
حيث :
M1 : تركيز المحلول الإبتدائي (قبل التخفيف)
M2 : تركيز المحلول النهائي (بعد التخفيف - أي عند إضافة مزيد من المذيب)
V1 : حجم المحلول الإبتدائي (قبل التخفيف - أي قبل إضافة المذيب)
V2 : حجم المحلول النهائي (بعد التخفيف - أي بعد إضافة المذيب)
من المعطيات السابقة
M1 = 12.23 , M2 = 1 , V1 = ?? ml , V2 =500ml
وبالتعويض فى القانون نجد أن :
M1 * V1 = M2 * V2
500 * 1 = V1 * 12.23
V1 = 40.88 ml
حجم الماء المضاف = حجم المحلول بعد التخفيف (V2) - حجم المحلول قبل التخفيف (V1)
حجم الماء المضاف = 500 - 40.88 = 459.12 مل
لتحضير 500 مل من HCl تركيزه 1M نضيف 40.88 مل من HCl الذي تركيزه 12.23M إلى 459.12 مل من الماء