كيفية التوصل لقانون سرعة التفاعل
- تعريف قانون سرعة التفاعل:
حاصل ضرب تراكيز المواد المتفاعلة في الخطوة البطيئة مرفوعاً كل مادة منها إلى أس يساوي معاملها.
استنتاج قانون سرعة التفاعل من خلال نتائج تجربة معملية
مثال (1):
- إذا حصل تفاعل بين ( H2 ) و ( I2 ) حسب المعادلة:
H2 + I2 → 2HI
فإذا ظهر من التجربة أن سرعة التفاعل تتناسب طردياً مع [H2] ، وأيضاً تتناسب طرديا مع [I2]
فإنه يمكن التوصل لقانون سرعة التفاعل كما يلي:
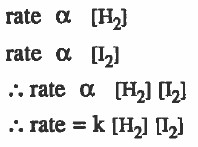
ثابت سرعة التفاعل = k
مثال (2):
إذا حصل تفاعل بين ( H2 ) و ( Br2 ) حسب المعاملة :
H2 + Br2 → 2 HBr
فإذا ظهر من التجربة أن سرعة التفاعل تتناسب طرديا مع [H2] ، وأيضاً تتناسب طرديا مع 1/2[Br2]
فإنه يمكن التوصل لقانون سرعة التفاعل كما يلي:
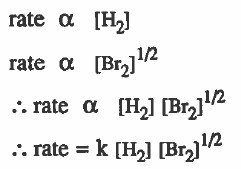
قاعدة هامة جداً
لا يمكن كتابة قانون سرعة التفاعل بمجرد النظر للمعادلة وإنما من خلال تجربة كيميائية نجريها
كيفية التعرف على قانون سرعة التفاعل من خلال المعلومات المعطاة في السؤال
(1) الحالة الأولى:
- إذا أعطيت في السؤال المعادلة التي تمثل الخطوة المحددة لسرعة التفاعل (الخطوة البطيئة) ، فإن قانون سرعة التفاعل يساوي حاصل ضرب تراكيز المتفاعلات مرفوعاً كل مادة منها إلى اس يساوي معاملها .
تطبيق: حسب التفاعل:
2NO(g) + 2 H2(g) → N2 (g) + 2 H2O (g)
فإذا كان التفاعل يمر بالخطوات التالية:
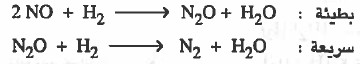
قانون سرعة التفاعل يؤخذ من الخطوة البطيئة وهو كما يلي:
rate = k [NO]2 [H2]
ملاحظة: من القانون السابق يتبين أن:
(1) سرعة التفاعل تتناسب طردياً مع تركيز الهيدروجين rate α [H2]
(2) سرعة التفاعل تتناسب طردياً مع مربع تركيز أكسيد النيتروجين rate α [NO]2
(2) الحالة الثانية:
إذا ذكر لك في السؤال أن التفاعل يمر بخطوة واحدة فقط فإن قانون سرعة التفاعل يساوي حاصل ضرب تراكيز المتفاعلات مرفوعاً كل مادة منها إلى أس يساوي معاملها في المعادلة المعطاة في السؤال.
تطبيق: حسب التفاعل:
2A (g) + 3D (g) → A2D3 (g)
وهذا التفاعل يمر بخطوة واحدة فقط ، لذا فإن قـانـون سـرعـة الـتـفـاعـل يؤخذ من المعادلة الاصلية مباشرة وهو كما يلي :
rate = k [A]2 [D]3
(3) الحالة الثالثة:
إذا أعطيت معلومات ناتجة من تجربة كيميائية ، فإنك تستخدم هذه المعلومات لكتابة قانون سرعة التفاعل.
تطبيق: حسب التفاعل:
2NO2 (g) + CO (g) → NO3 (g) + NO (g)
وتبين من التجربة أن سرعة التفاعل تتناسب طرديا مع 2[NO2] فقط .
فإن قانون سرعة التفاعل يؤخذ من المعلومات المعطاة في السؤال ، (نتائج تجربة العلاقة بين سرعة التفاعل وتراكيز المواد المتفاعلة) . لذلك فإن قانون سرعة التفاعل يصبح كما يلي:
rate = k [NO2]2