كلورات البوتاسيوم Potassium Chlorate
- مركب كيميائي يتكون من عناصر البوتاسيوم والكلور والأكسجين.
- الصيغة الكيميائية لكلورات البوتاسيوم هي KCIO3
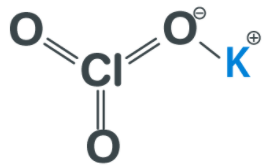
- يوجد كلورات البوتاسيوم في الشروط القياسية على شكل بلورات بيضاء اللون عديمة الرائحة.
- تذوب فى الماء بسهولة.
- لكلورات البوتاسيوم خواص مؤكسدة
- مادة كلورات البوتاسيوم مادة مهيجة وضارة بالبيئة

- تتم عملية تحضيره من خلال تمرير غاز الكلور في محلول ساخن من البوتاس الكاوية
(3Cl2(g) + 6 KOH(aq) → KClO3(aq) + 5 KCl(aq) + 3 H2O(l
- يدخل مركب كلورات البوتاسيوم فى العديد من الصناعات حيث :
(1) يستخدم كعامل مؤكسد
(2) يستخدم في تحضير غاز الأكسجين
(3) يدخل صناعة الكبريت
(4) يدخل صناعة المطهرات
(5) يستخدم صناعة المتفجرات والألعاب النارية
التحلل الحراري لكلورات البوتاسيوم
- يؤدي تسخين كلورات البوتاسيوم إلى حدوث تفاعل أكسدة - اختزال على نفس المركب (تفاعل عدم تناسب):
4KClO3 → 3KClO4 + KCl
تفاعل عدم التناسب (Disproportionation)
- هو نوع خاص من تفاعلات أكسدة-اختزال التي يتم فيها حدوث تفاعل أكسدة واختزال على نفس العنصر من عناصر المواد الداخلة في التفاعل، مما يؤدي في النهاية إلى الحصول على ناتجين مختلفين.
- أي أن العنصر الذي يدخل في تفاعل عدم تناسب يكون مؤكسداً ومختزلاً في نفس الوقت. بالتالي تتغير حالة الأكسدة للعنصر إلى حالتين اثنتين، واحدة أعلى (أكسدة) وأخرى أخفض (اختزال).
- أما الاستمرار بالتسخين فيؤدي إلى تفكك المركب
2KClO3 → 2KCl + 3O2
- درجة حرارة تفكك كلورات البوتاسيوم هي 400Co تقريباً
العوامل الحفازة للتحلل الحراري لكلورات البوتاسيوم
- الهدف من وجود العوامل الحفازة هنا هو تقليل درجة حرارة التفكك عن 400Co
- التحلل الحراري لكلورات البوتاسيوم فى وجود MnO2 تنخفض درجة حرارة التفكك من 400Co إلي 350Co.
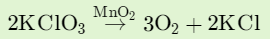
- - التحلل الحراري لكلورات البوتاسيوم فى وجود الكربون المنشط activated carbons تنخفض درجة حرارة التفكك إلى 320Co - 325Co.
- التحلل الحراري لكلورات البوتاسيوم فى وجود Na2S تنخفض درجة حرارة التفكك إلى 220Co
- لقراءة التجربة الفعلية للتحلل الحراري لكلورات البوتاسيوم فى وجود عامل حفاز يرجى قراءة هذا الملف:
THE DECOMPOSITION OF POTASSIUM CHLORATE