النموذج الذري لراذرفورد
- كان راذرفورد أول من عارض نموذج (بودنج الزبيب)
- أدرك راذرفورد أن الألكترونات (السالبة الشحنة) ليست مدفونة في النواة (موجبة الشحنة) كما هو الحال في نموذج (بودنج الزبيب) ولكنها على العكس من ذلك تدور على مسافات شاسعة حول النواة الكثيفة الموجبة الشحنة والتى تتركز فيها كتلة الذرة.
- سمى هذا النموذج (نموذج الكواكب السيارة) لتشابهه مع نظام المجموعة الشمسية.
تجربة راذرفورد
** في عام 1911م قام العالم الإنجليزي ايرنست رذرفورد بتجربته الشهيرة المسماة بتجربة رقيقة الذهب (Gold Foil Experiment) والتي كانت لها أثر متميز في صياغة النظرية الذرية الحديثة.
- في هذه التجربة أسقط رذرفورد أشعة ألفا (أشعة ألفا عبارة عن تيار من نويات عنصر الهليوم (He على رقيقة الذهب.
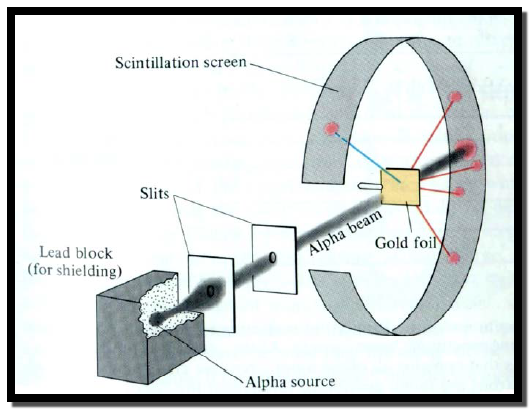
لاحظ رازفورد مايلي:
(1) العدد الكبير من جسيمات أشعة ألفا (Alpha particles) مر بمسار مستقيم من خلال الرقيقة.
(2) عدد قليل يقدر بــــ 1/8000 من جسيمات ألفا المنحرفة عن المسار المستقيم ارتدت وبشكل مستقيم باتجاه مصدر الأشعة.
لقد تم تفسير نتائج أو ملاحظات التجربة كالتالي:
(1) انحراف العدد القليل من جسيمات أشعة ألفا موجبة الشحنة يشير إلى مرورها بالقرب من جسيم ذري متمركز يحمل شحنة موجبة، أما الارتداد المستقيم لبعض الأشعة المنحرفة فهذا ناتج عن اصطدامها بالجسيم الذري الموجب.
(2) مرور القسم الأكبر من أشعة ألفا يعني وجود مساحات فارغة (Empty Spaces) بين الجسيم الذري الذي يحمل الشحنة الموجبة والإلكترونات ذات الشحنة السالبة والتي تحدد حجم الذرة.
- التجارب اللاحقة التي قام بها رذرفورد كشفت على أن الجسيم الكثيف ذات الشحنة الموجبة (النوية) يحتوي على جسيمات صغيرة تحمل شحنة موجبة تدعى البروتونات(Protons) سرعان ما أدرك رذرفورد أن البروتونات هي ليست المكون الوحيد للنويه وذلك من خلال الفرق بين مجموع كتل هذه البروتونات وكتلة النوية، لهذا السبب توقع رذرفورد وجود جسيمات أخري متعادلة الشحنة في النوية.
فروض رذرفورد عن تركيب الذرة
(1) يوجد في مركز الذرة نواة موجبة الشحنة.
(2) عدد البروتونات الموجبة داخل النواة يساوى عدد الإلكترونات السالبة التي تدور حول النواة .
(3) أثناء دوران الإلكترون حول النواة تنشأ قوة طاردة مركزية ناتجة عن سرعة دوران الإلكترونات تتعادل مع قوة الجذب المركزية الناتجة من جذب النواة للإلكترونات .