مبدأ لوتشاتلييه Le Châtelier’s Principle
- في عام 1888م اكتشف العالم الفرنسي هنري لويس لوتشاتليه أن هناك طرائق للتحكم في الاتزان لجعل التفاعل أكثر إنتاجًا.
- ينص مبدأ لوتشاتلييه على:
إذا بُذل جهد على نظام في حالة اتزان فإن ذلك يؤدي إلى إزاحة النظام في اتجاهٍ يخفف أثر هذا الجهد.
- والجهد هو أي تغيير يؤثر في اتزان نظام معين.
مثال لتوضيح مبدأ لوشاتيلييه
- فى تفاعل أنتاج الميثان التالي:
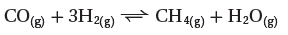
- هذا التفاعل في حالة اتزان فماذا يحدث إذا تم الآتي:
أولاً / إضافة أحد المواد المتفاعلة
- إذا أُضيفت كمية من أول أكسيد الكربون إلى وعاء التفاعل وزادت تركيزه فسيؤدي ذلك إلى زيادة عدد التصادمات الفعالة بين جزيئات غاز أول أكسيد الكربون CO وجزيئات الهيدروجين H2 ويؤثر ذلك في اتزان التفاعل؛ إذ تزيد سرعة التفاعل الأمامي، كما هو موضح من السهم الأطول الذي يشير نحو اليمين في معادلة التفاعل.
- مع الوقت تقل سرعة التفاعل الأمامي مع انخفاض تركيز كل من CO , H2 وفي الوقت نفسه تزداد سرعة التفاعل العكسي مع أنتاج المزيد CH4 , H2O حتى يصل التفاعل إلى موضع اتزان جديد.
الخلاصة: تؤدي زيادة في تركيز أي من المتفاعلات إلى الإزاحة نحو اليمين وزيادة النواتج
ثانياً/ إزالة أحد النواتج
- إذا تم إزالة الماء H2O الناتج عن التفاعل بإضافة مجفف (مادة تمتص الماء) إلى وعاء التفاعل.
- سوف تتم إزاحة الاتزان نحو الاتجاه الذي يزيد من تركيز الماء مرة أخري.
- وهذا يعنى إزاحة الاتزان نحو اليمين وتكوين من النواتج.
- يعيد تفاعل الاتزان الماء الذي تمت إزالته؛ حيث يزيد إنتاج الماء لتعويض النقص.
الخلاصة: في أي نظام متزن تؤدي إزالة أي كمية من أي من النواتج إلى إزاحة الاتزان نحو الجهة اليمنى، وإنتاج المزيد من النواتج.
ثالثاً / إضافة أحد النواتج
إذا تمت إضافة أحد النواتج إلى تفاعل فى حالة إتزان فأن ذلك يؤدي إلى إزاحة الإتزان ناحية اليسار (تكوين المتفاعلات). ومن ثم تخفيف الجهد بتحويل النواتج إلى متفاعلات.
- كما أنه إذا تم إزالة أحد المتفاعلات فسوف يحدث إزاحة مشابهة نحو اليسار.
وهذا ملخص لما سبق
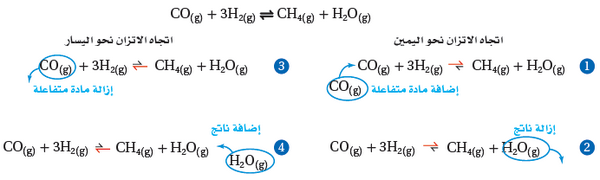
- تعمل إضافة أو أزالة أحدي النواتج أو إحدى المتفاعلات على إزاحة الاتزان نحو الاتجاه الذي يخفف الجهد.
- لاحظ الأسهم غير المتساوية التى تدل على اتجاه الإزاحة.
رابعاً/ الحرارة وموضع الأتزان
- إذا أضيفت كمية من الحرارة إلى نظام متزن فإن الاتزان - وفقاً لمبدأ لوتشاتيليه- يتجه نحو الاتجاه الذي تستهلك فيه الحرارة لذا يزاح الاتزان نحو اليسار ويقلل من تركيز الميثان CH4
- أما خفض درجة الحرارة فيؤدي إلى إزاحة الاتزان نحو اليمين؛ لأن التفاعل الأمامي ينتج طاقة ويقلل من الجهد، لذا تنتج كمية أكبر من الميثان.
