قانون النسب المتضاعفة Low of Multiple Proportions
تعريف قانون النسب المتضاعفة
ينص القانون على أن:
"عندما يتحد عنصران ليكونا أكثر من مركب واحد ، فإن النسبة بين الكتل المختلفة من احد العنصرين والتي تتحد مع كتلة ثابتة من العنصر الآخر تكون نسبة عددية صحيحة وبسيطة".
مثال توضيحي (1) :
يمكن أن يتحد الهيدروجين مع الأكسجين ليكون أحد المركبين التاليين :
الماء (H2O ) أو فوق أكسيد الهيدروجين (H2O2 )
حيث يتحد مثلأ 2gمن الهيدروجين مع 16g من الأكسجين ليكون الماء ،
ويتحد 2g من الهيدروجين مع 32g من الأكسجين ليكون فوق أكسيد الهيدروجين أي أن وزن الأكسجين في المركب الأول إلى المركب الثاني هي 32 : 16
أي أن النسبة 2 : 1 وهذه النسبة عددية صحيحة وبيسيطة .
مـثـال توضيحي (٢):
يمكن ان يتحـد الأكسجين مع الكربون ليكون أحد المركبين التاليين :
أول أكسيد الكربون (CO) أو ثاني أكسيد الكربون (CO2 )
حيث يتحد مثلاً 12g من الكربون مع 16g من الأكسجين ليكون أول أكسيد الكربون . ويتحد 12g من الكربون مع 32g من الأكسجين ليكون ثاني أكسيد الكربون.
أي أن وزن الأكسجين في المركب الأول إلى المركب الثاني هي: 16 : 32
أي أن النسبة 1 : 2 وهذه النسبة عددية صحيحة وبيسيطة.
أمثلة أخرى :
(1) ثاني أكسيد الكبريت SO2 و ثالث أكسيد الكبريت SO3 حيث تكون النسبة 2:3
(2) كلوريد الحديد FeCl2 II و کلوريد الحديد FeCl3 III حيث تكون النسبة 2:3
(3) أول أكسيد النيتروجين NO و ثاني أكسيد النيتروجين NO2 حيث تكون النسبة 2:1
(4) أكسيد النحاس Cu2O I و أکسيد النحاس CuO II حيث تكون النسبة 2:1
مسائل محلولة
مثال (1): يشكل العنصران A و B مركبين مختلفين ، في المركب الأول 0.3g من A يتـحـد مع 0.5g من B وفي المركب الثـانـي تـتـحـد 0.15g من 1 مع 0.5g من B . كيف توضح قانون النسب المتضاعفة من خلال الأرقام المعطاة.
الحل:
نلاحظ ان هناك وزن ثابت من العنصر B وهو 0.5g .
ولإيجاد النسبة نقسم وزن A في المركب الأول على وزن A في المركب الثاني .

أي أن النسبة 1:2 وهذه نسبة عددية صحيحة وبسيطة ، وهذا يحقق القانون.
مثال (2): يؤلف الحديد مع الكلور نوعين من كلوريد الحديد وقد دلت التجارب أن النسب الوزنيـة لـلـحـديد في المركبين هي % 44.1 و % 34.5 . أشـرح مـدى تطابق هذه النتائج مع قانون النسب المتضاعفة .
الحل:
نفترض أن وزن كل مركب 100g ، وهذا يعني أن :
في المركب الأول : وزن الحديد = 44.1g ، وزن الكلور= 55.9g
في المركب الثاني : وزن الحديد = 34.5g ، وزن الكلور = 65.5g .
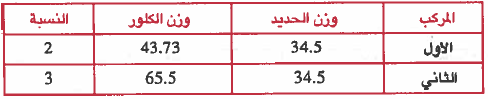
ويمكن تبسيط النتائج في الجدول التالي :

وحيث أن قانون النسب المنضاعفة يشترط ثبات وزن أحـد الـعنصرين في كلا المركبين لذا نثبت وزن الحـديـد وذلك بتغيير وزن الحديد في المركب الأول من (44.1g) إلى (34.5g) وسوف يرتبط بهذا التغيير تغير وزن الأكسجين في نفس المركب ، وذلك حسب قانون النسب الثابتة ليصبح كالتالي:
كل 44.1g من الحديد يتفاعل مع ← 55.9g من الكلور
إذن 34.5g من الحديد يتفاعل مع ← (X) g من الكلور
وزن الكلور اللازم للتفاعل مع 34.5g من الحديد =
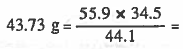
ولمعرفة النسبة نقسم وزن الأكسجين في المركب الثاني على وزن الأكسجين في المركب الأول:

أي أن النسـبـة 3 : 2 وهذه نسـبـة عـددية بسيطة وصـحـيـحـة ،وهذا يـحـقـق قـانون النسب المتضاعفة . ويمكن توضيح النتائج بعد التعديل من خلال الجدول التالي: