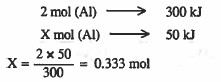
مثال (7): حسب المعادلة التالية:
2Al + 2NaOH + 4H2O → 2NaAlO3 + 5H2+ 300 kJ
احسب عدد مولات الالمنيوم (Al) المتفاعلة عندما تنطلق طاقة مقدارها 50kJ.
الحل:
من المعادلة الكيميائية الحرارية:
مثال (8): احسب طاقة احتراق 6.4g من الهيدرازين N2H4:
N2H4 (l) + O2 (g) → N2 (g) + 2 H2O (1)
ΔH = - 622.16 kJ
الحل :
من المعادلة الكيميائية تلاحظ ان إشارة ΔH بالسالب وهذا يعني أن التفاعل طارد للحرارة وبذلك يمكن كتابة المعادلة الكيميائية الحرارية كما يلي:

مثال (9): حسب التفاعل التالي:
1/2O2 (g) + H2 (g) → H2O (l)
ΔHo = - 286 kJ
إذا كانت كثافة الأكسجين تساوي 1.11g/L فاحسب كمية الحرارة المنطلقة بوحدة (kJ) لدى تفاعل 2L من الأكسجين مع زيادة من الهيدروجين عند نفس الظروف.
الحل :
عدد المولات = n , الوزن الجزيئي = M , الكثافة = d , الحجم = V , الوزن = m
من المعادلة الكيميائية نلاحظ ان إشارة ΔH بالسالب وهذا يعني أن التفاعل طارد للحرارة
وبذلك يمكن كتابة المعادلة الكيميائية الحرارية كما يلي:

مثال (10): احسب ΔHo للتفاعل:
(g) N2 (g) + 3H2 (g) → 2NH3
إذا علمت أن الحرارة الناتجة من تكون ( 0.017kg ) من النشادر عند الظروف الـقـيـاسـيـة تساوي 46kJ.
الحل:
لاحظ أنه لكي نحسب ΔHo للمعاملة السابقة فيجب أن نحسب الحرارة الناتجة عن تكون مولين من NH3 حسب المعادلة.

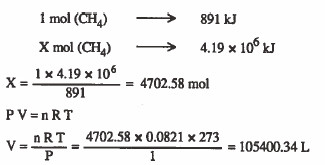
مثال (11): احسب حجم الميثان CH4 عند الظروف القياسية اللازم لإنتاج كمية من الطاقة قدرها 106 × 4.19 كيلو جول إذا علمت أن حرارة احتراق الميثان 891kJ / mol -
الحل: