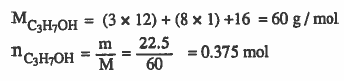الكسرالمولي Mole Fraction
- تعريف الكسر المولي (X) هو النسبة بين عدد مولات المركب إلى العدد الكلي لمولات جميع المواد المكونة للمحلول .
- القانون المستخدم:
- إذا كان لدينا محلول مكون من المواد A , B, C فإن الكسر المولي للمادة (A) هي :

nt = المجموع الكلي للمولات ،
- لا تنسى أن: مجموع الكسور المولية = 1
مسائل محلولة على الكسر المولي
مثال (1): ماذا نعني عندما نقول أن الكسر المولي لهيدروكسيد الصوديوم المذاب في الماء يساوي 0.3 ؟
الحل :
نعني ان كل 0.3mol من هيدروكسيد الصوديوم مذاب في 1mol من المحلول.
أو نعني أن كل 0.3mol من هيدروكسيد الصوديوم مذاب في 0.7mol من الماء.
مـثـال (2): إذا كان لدينا مـحلول مكون من ملح الطـعـام مـذاب في الماء ، فـإذا كـان الكسر المولي لملح الطعام (0.25) فاحسب الكسر المولي للماء.
الحل:
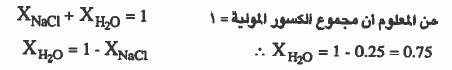
مثال (3): ما الكسر المولي لكلوريد الصوديوم في محلول يحتوي على (1mol) من كلوريد الصوديوم مذاب في 8mol من الماء
الحل :
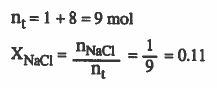
مـثـال (4): احـسب الكسر المولي لـحـمـض الخل CH3COOH في مـحـلـول حـضـر بإذابة 120g من حمض الخل في 108g من الماء .
الحل :
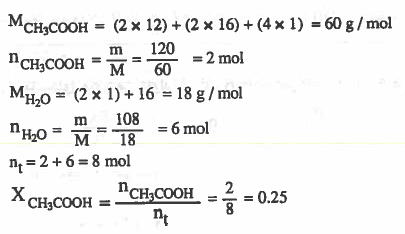
مـثـال (5) عند إذابة ( 3mol ) من (NaCl) في (90g) من الماء فـأحـسب الكسر المولي للملح والماء.
الحل:
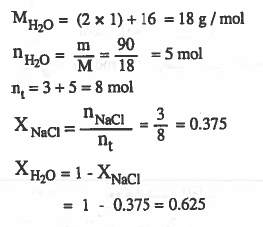
مثال (6): احسب النسبة المئوية الوزنية للكحول الايزوبروبيلي (C3H7OH) إذا كان كسره المولي في الماء يساوى (0.375) وكتلته تساوي 22.5g؟
الحل :