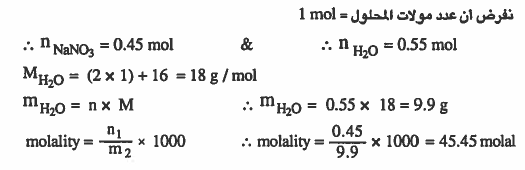المولالية Molality
تعريف المولالية (m)
هي عدد المولات (الجزيئات الجرامية) من المذاب في كيلو جرام من المذيب .
القانون الرياضى لحساب المولالية
يمكن استخدام القانون التالي فى حساب المولالية

ملاحظات هامة
- التركيز بالمولالية = molality = m
- وزن المذاب ( كتلة المذاب ) = m1
- وزن المذيب ( كتلة المذيب ) = m2
- وزن المحلول ( كتلة المحلول ) = msol
- عدد مولات المذاب = n1
- عدد مولات المذيب = n2
- للمعلومية: مذاب ( Solute ) ، مذیب ( Solvent ) ، محلول ( Solution )
- وحدة التركيز بالمولالية = mol . kg-1 = mol / kg = molal
- عند التحويل من التركيز بالمولالية إلى الكسر المولي أو النسبة المئوية الوزنية فإننا سوف نحتاج إلى الوزن الجزيئي أو وزن الصيغة.
مسائل محلولة على المولالية
مثال (1): ماذا نعني عندما نقول أن تركيز محلول ملح الطعام 2.5molal
الحل :
- نعني أن كل (2.5mol) من ملح الطعام مذاب في 1kg من المذيب .
- أو نعني أن كل (2.5mol) من ملح الطعام مذاب في 1000g من المذيب.
مـثـال (2): احـسـب الـتـركـيـز بالمولالـيـة لمحلول تم تـحـضـيـره بإذلية ( 2mol ) من حمض الكلور في 800g من الماء.
الحل:
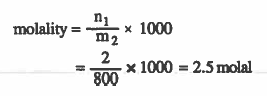
مثال (3): عند إذابة 20g من كلوريد الصوديوم (NaCl) في كمية من الماء بحيث تصبح كتلة المحلول 90g ، احسب مولالية المحلول. ( Na = 23 & C = 35.5 )
الحل :
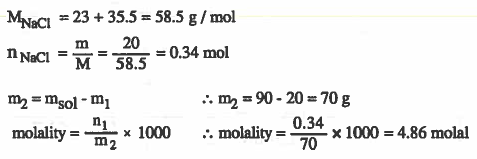
مثال (4): ما وزن كبريتات الأمونيوم NH4)2SO4) التي يلـزم إذابتهـا في 350g من الماء لتكـوين محلول تركيزه (0.3molal) ؟
الأوزان الذرية : ( 32 = H = 1 & N = 14 & O = 16 & S )
الحل :
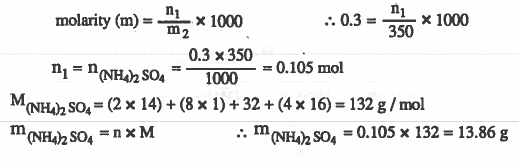
مـثـال (5): احـسـب المولاليـة للكحول الإيثـيـلـي (C2H5OH) النـاتـج عـن إذابـة 3mol من الكحول في 45mol من الماء. الكتل الذرية :1 = O = 16 , H
الحل :
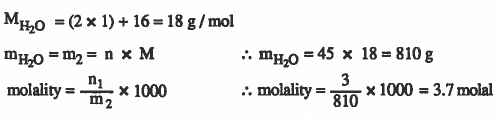
مثال (6): احسب المولالية لمحلول مكون من 9.8g من حمض الكبريت في 200mL من المحلول . كثافة المحلول 1.2g / mL
الأوزان الذرية: ( 32 = H = 1 & O = 16 & S )
الحل :
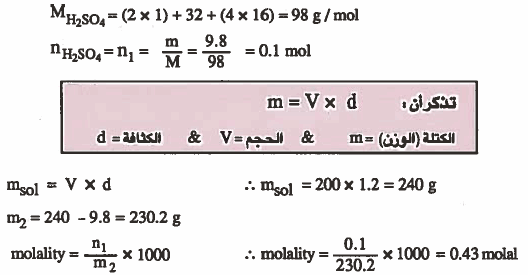
مـثـال (7): احـسـب الـجـزيـئـيـة الـوزنـيـة (المولاليـة) لمحلول هيدروكسيد الصوديوم NaOH المائي عندما تكون النسبة المنوية الوزنية لـهيدروكسيد الصوديوم (14%) .
الأوزان الذرية : 23 = H = 1 & O = 16 & Na
الحل:

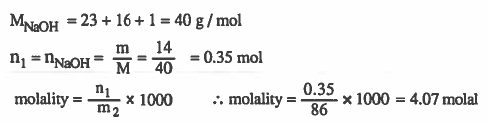
مثال(8): محلول مائي لحمض الخل CH3COOH ترکیزه 10.2molal احسب:
(۱) الكسر المولي للمذاب والمذيب
(۲) النسبة المئوية الوزنية للحمض.
الحل:

مـثـال (9): مـحـلـول مـائـي لنـتـرات الصـوديوم NaNO3 الكسـر المولي لـنتـرات الصوديوم فيه 0.45 احسب التركيز بالمولالية .
الحل: