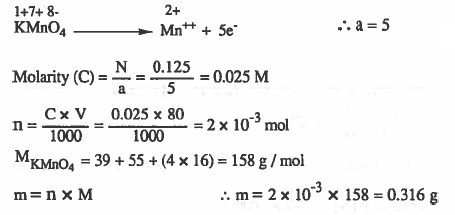العيارية Normality
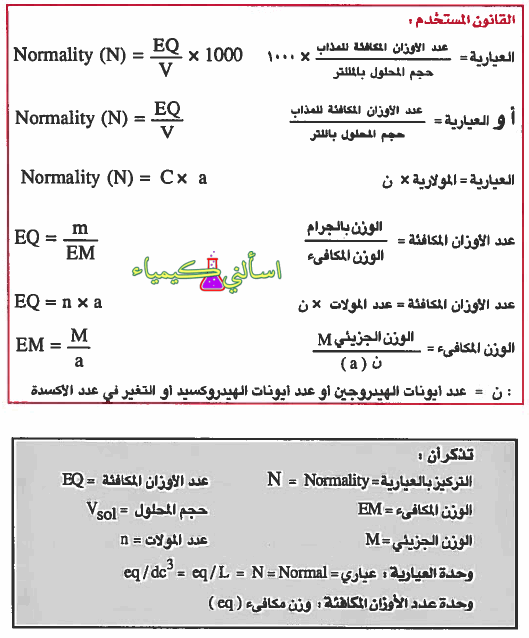
- تعريف العيارية (N): هي عدد المكافئة الجرامية من المذاب في لتر من المحلول.
- القوانين المستخدمة لحساب العيارية
نوصي بمراجعة الدرس التالي: مسائل محلولة على طريقة حساب الأوزان المكافئة للمركبات الكيميائية؟ قبل قراءة هذا الموضوع
مسائل محلولة على العيارية
أولاً/ تطبيقات على الأوزان الكافئة للحموض والقواعد
مثال (1): احسب التركيز بالعيارية لحمض H3PO4 تركيزه 0.3M .
الحل:

مـثـال (2): أحـسـب عـبـاريـة مـحـلول HCl في الماء إذا أذيب (0.5eq HCl) في كمية من الماء بحيث يصبح حجم للحلول (500mL) .
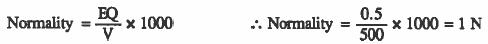
الحل:
مثال (3): احـسـب عـيارية المحلول الناتج عن إذابة 19.5g من H2SO4 في الماء ليتكون محلول حجمه 800mL .
الأوزن الذرية: (H=1 , O = 16 , S = 32 )
الحل:
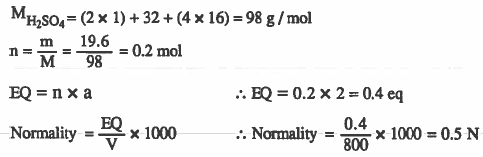
مثال (4): كم جـرامـاً من هيدروكسيد الصوديوم الذي يوجـد في 500mL من محلول NaOH عياريته 0.0412N .
الأوزان الذرية: (H= 1 , O = 16 , Na = 23 )
الحل:
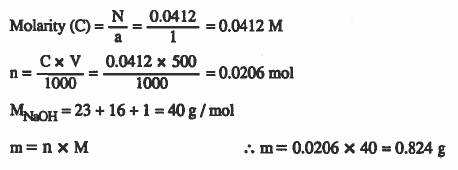
مثال (5): أحسب حجم محلول هيدروكسيد الكالسيوم 2(Ca(OH الذي تركيزه 0.23N ويحتوي على 20g من هيدروكسيد الكالسيوم>
الأوزان الذرية : 40 = H = 1 , O = 16 , C
الحل:
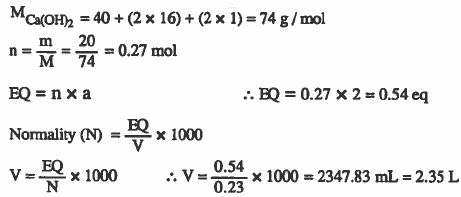
ثانياً/ تطبيقات على الأوزان المكافئة فى تفاعلات الأكسدة والاختزال
مثال (6): ما عيارية محلول ديكرومات البوتاسيوم K2Cr2O7 الذي يحتوي على 35ml منه على 3.87g من K2Cr2O7 علماً بأن ناتج للتفاعل +++Cr .
الأوزان الذرية : 16 = K = 39 , Cr = 52 , O
الحل:
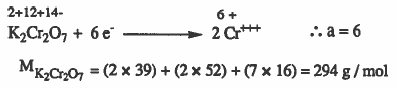

مـثـال (7): احـسب وزن KMnO4 اللازمة لعمل 80cm3 من محلول برمنجنات البوتاسيوم الذي تركيزه 0.125N . (ناتج التفاعل ++Mn )
الأوزان الذرية : 16 = K = 39 , Mn = 55 , O
الحل: