الرنين Resonance
- يسمى أيضاً بالطنين أو التأرجح.
- تعريف الرنين: هو تمثيل الجزيء أو الأيون بطريقتين أو أكثر بحيث تختلف عن بعضها بتوزيع إلكترونات التكافؤ ، ولا تختلف في ترتيب الذرات. أو هو وجود عدد من بنائات أو صيغ لويس الممكنة لنفس الجزيء أو الأيون.
- نستنتج من ذلك أنه إذا امكن رسم أكثر من شكل بنائي لجزيء أو أيون واحد فإننا نقول أن هذا الجزيء أو الأيون أنه يحمل صفة الرنين ، وهذه الصفة هي صفة افتراضية تم قبولها لتفسير بعض النتائج العملية.
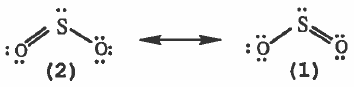
- ولتوضيح ذلك نأخذ الجزيء (SO2) كمثال . وقد وجد أن ترکیب لويس يمكن تمثيله بأحد التركيبين التاليين:

ملاحظة: لتوضيح كيفية التوصل لتركيبي لويس السابقين أقرا هذا الدرس: رسم تركيب لويس
- وبالنظر إلى تركيبي لويس السابقين نلاحظ وجود رابطتين مختلفتين وهما : رابطة أحادية (S - O) ورابطة ثنائية (S = O) ، وحسب مـعـلـومـاتنا السابقة أن الرابطة الأحادية أطول من الرابطة الثنائية .
- ولكن وجد عملياً عند قياس طول الرابطتين هو أن رابطتي الكبريت مع الأكسجين متساويتين في الطول ، وهذا يجعلنا نشك أن تركيبي لويس السابقين غير مرضيين . ولحل هذه المشكلة سوف تدخل مفهوم ( الرنين ) ، حيث نفترض أن التركيب الحقيقي للجزيء SO2 هو خليط أو هجين رئيني ( Resonance hybird ) للتركيبين (1) و (2) . وكل واحد منها يسمى التركيب أو الشكل الرئيني (Resonance Form) .
وترمز لعملية الرنين بالسهم ↔ كما يلي:
- نستنتج مما سبق أن ظهور فكرة الرنين (وجـود الأشكال الرنينية) هو حل لتغطية النقص الحاصل في تركيب لويس، ويمكن توضيح ذلك كـمـا يلي:
نظرية لويس افـتـرضت ان إلكترونات الرابطة لها مكان مـحـمد وهو بين الذرتين . ولكن نظرية لويس وقفت عـاجـزة عن تحديد مكان الزوج الإلكتروني الذي يكون الرابطة المضـاعـفـة فـي جـزيء SO2 مثلاً.
ولذلك ظهرت فكرة الرنين (الطنين) والتـي افـتـرضت أن الإلكترونات ليس لهـامكان مـحدد unlocalized ، وبذلك أمكن تفسير حقيقة الروابط في كثير من الجزيئات مثل : CO3- , CO2 , SO2 إلى غير ذلك.
ملاحظات هامة عن الأشكال الرنينية السابقة
- يمكن تمثيل التركيب الحقيقي ( الهجين الرنيني ) للجزيء SO2 بالبناء التالي:
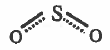
- الروابط في الهجين الرنيني متساوية في الطول والقوة والتردد التذبذبي .
- خصائص التركيب الحقيقي للجزيء هي مـتـوسطة بين (1) و (2) . ولذلك وجد أن طول الرابطة بين الكبريت والاكـسـجـيـن أقـصـر من الرابطة المنفردة ( S - O ) وأطول من الرابطة المزدوجة (S = O) ، أي أنها وسط بين الرابطتين.
السهم (↔) لا يدل على أن الـتـركـيـب ينتقل ذهاباً وإياباً من (1) إلى (2) أو العكس ، والصحيح أن السهم (↔) يدل على:
(1) أن التركيب الحقيقي للجزيء SO2 هو هجين من التركيبين .
(2) أنه يمكن تمثيل الجزيء بأكثر من تركيب .
- الهجين الرئيني للجزيء أقل طاقة (أكثر استقراراً) مـن الـتـراكيب المكونة له (1) و (2) وذلك لأن عملية الرنين ينتج عنها طرد للطاقة ، وهذه الطاقة تسمى طاقة الرنين .

خصائص الأشكال الرنينية ( الطنينية)
(1) الروابط تكون فيها متماثلة في الطول والقوة والتردد التنبذبي .
(2) مواقع الذرات وعدد الروابط وعدد الإلكترونات المفردة ثابت في الأشكال الرئينية للجزئ أو الأيون الواحد .
(3) تختلف الأشكال الرنينية عن بعضها البعض في توزيع وترتيب الإلكترونات الخارجية (إلكترونات التكافؤ) فقط .
(4) الشكل البنائي الطنيني للجزيء أو الأيون لا يعتبر خليط او اتزان بين الأشكال الرنينية ، وإنما يعتبر هجين (Hypird) ناتج عن اتحاد أو مزج الاشكال الرئينية.
(5) كلما زادت الأشكال البنائية الرنينية للجزيء أو الأيون يزداد ثباته.
(6) الهجين الرئيني أقل طاقة (أكثر استقرار) من جميع الأشكال الرنينية المكونة له بمقدار من الطاقة يسمى طاقة الرنين (Resonance Energy) ، وكلما زادت طاقـة الرنين يزداد ثبات الجزيء أو الأيون.
الأشكال الرنينية (الطنينية) المرفوضة
قد يكون هناك بعض الأشكال الرئيئية (الطنينية) المرفوضة لأسباب منها:
(1) وجود ذرتين متجاورتين تحملان نفس الشحنة.
(2) وجود شحنة موجبة مثلاً على ذرة ذات سالبية كهربية مرتفعة مثل الاكسجين.
تابع هذا الدرس : أمثلة وتمارين على أشكال الرنين