نوع التهجين في جزئ الماء H2O؟
(1) نكتب التركيب الإلكتروني لذرة الأكسجين في الحالة المستقرة:
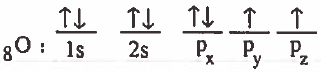
تركيب لويس لجزيء H2O هو:
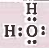
نلاحظ أن حول الذرة المركزية أربعة أزواج إلكترونية، فإنه حسب نظرية ( VSEPR ) سوف تتوزع الأزواج الإلكترونية في اركان هرم رباعي السطوح ، وهذا يعني أن التهجين من نوع sp3.
وبذلك فنحن في حـاجـة أربعـة مـدارات مـتـساوية في الطاقة بحيث يكون مدارين منها يحتوي كل منهما على إلكترون منفرد
ملاحظة: في هذه الحالة لن نحتاج لنقل إلكترون لأنه متوفر لدينا إلكترونان مفردان .
(2) تحدث عملية دمج بين ثلاث مجالات من (p) والمجال (2s) لينتج أربع مدارات مهجنة متساوية في الشكل والطاقة ويرمز لكل منهما (sp3) .
ويحتـوى مـداران منها على إلكترون منفرد اما المداران الآخران فيحتوي كل منهما على زوج الكتروني حر .
التركيب الإلكتروني لذرة الأكسجين بعد التهجين:
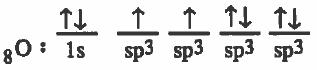
(3) يحدث تداخل بين مجال (1s) من ذرة الهيدروجين ومجالين من (sp3) المهجن من ذرة الأكسجين لتتكون رابطتين تساهميتين.
وهذه الرابطتان متساويتان في الشكل والطاقـة أمـا المدار الثالث والرابع من (sp3) فيحتوي كل منهما على زوج من الإلكترونات الحرة
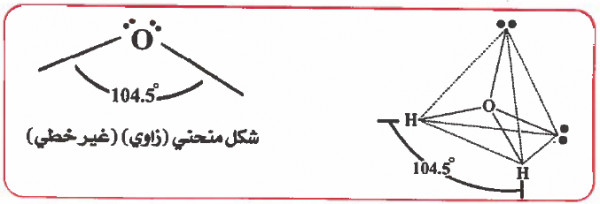
وحيث أن الزوج الإلكتروني غير الرابط أكثر طاقة من الزوج الرابط لذا فإنه يشغل حيز أكبر في الفراغ وبالتـالي سوف يزداد التنـافـر بين إلـكـتـرونـات الأزواج الـحـرة وإلكترونات الأزواج للرابطة وبالتالي تقل الزاوية بين الرابطتين في الماء لتصبح الزاوية HOH تساوي (104.5o) .
وحيث أن المركب ينتمي إلى النوع (AX2E2) ، إذنالشكل الهندسي للجزيء هـو زاوي (منحني) Angular
من الأمثلة المشابهة للماء H2O في التهجين والشكل الهندسي:
OF2 & H2S & ClF2+ & SF2 & SCl2 & OCl2 & ClO2- & NH2- & Cl2O
ملاحظة: إذا رمزنا بالرمز (LP) للزوج الحر ورمـزنـا لـ (BP) للزوج الرابط ، فـإن طاقـات التنافر تترتب كما يلي:
LP-LP > LP - BP > BP - BP