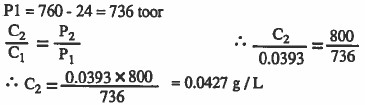أثر الضغط على ذائبية الغازات في السوائل
- عند ثبوت درجة الحرارة تزداد ذوبانية الغازات في السوائل بزيادة ضغط الغاز فوق سطح السائل.
- بمعنى أنه كلما زاد تركيز جزيئات الغاز فوق السائل يزداد ذوبان جزيئات الغاز فيه.
- وقد توصل هنري إلى علاقة بين ضغط الغاز وذائبيته.
قانون هنري
- تعريف قانون هنري: " كـمـيـة الغاز المذابة في كتلة معينة من السائل المذيب عند درجة حرارة معينة تتناسب طردياً مع الضغط الجزئي للغاز فوق السائل".
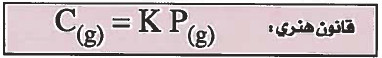
(g)C = تركيز الغاز (كمية الغاز) .
K = ثابت قانون هنري ، ويعتمد على طبيعة الغاز والسائل .
P(g) = الضغط الجزئي للغاز .
ملاحظات على قانون هنري
(1) يستفاد من القانون السابق في حساب كمية الغاز المذابة في مذيب ما.
(2) لا تنطبق العلاقة السابقة على الغازات التي تتفاعل مع المحلول.
(3) لا تنطبق العلاقة السابقة على الغازات شديدة الذوبان في السائل المذيب ، وكذلك التي لها خواص التفكك إلى أيونات أو التي لها خواص تجمعية.
(4) ينطبق القانون عندما تكون درجة الحرارة مرتفعة والضغط منخفضاً.
- لا يمكن تطبيق قانون هنري على ذائبية غاز كلوريد الهيدروجين في الماء وذلك لأن كلوريد الهيدروجين شديد الذوبان في الماء ، وكذلك لأنه يتفكك في الماء إلى أيونات
- يزداد ذوبان الغازات في السوائل بازدياد الضغط . يمكن تفسير ذلك باستخدام مبدأ لوشاتيليه:
(aq) محلول ↔ (g) مذاب + (l) مذیب
فعند زيادة الضغط فإن الجهة اليسرى تتأثر بالضغط بشكل أكبر ، أي ان كمية الغاز سوف تقل (تذوب) لتكوين زيادة من المحلول.
(5) حتى يمكن تطبيق القانون السابق يجب أن يكون النظام مغلق ، لأن النظام سوف يصل إلى حالة اتزان بين الضغط الجزئي فوق المحلول وكمية الغاز المذابة. وكما هو معلوم ان من خواص الاتزان استمرار الاتزان الديناميكي (النشط) بحيث أن كمية الغاز التي تفـقـد من المحـلـول يـقـابـلـهـا كـمـيـة مـسـاويـة تـدخل من الـغـاز إلى المحلول . وهذه الحالة تستمر طوال الزمن مادام النظام في حالة اتزان وعند ثبوت درجة الحرارة .
(6) بالنسبة لخليط من الغازات فإن كل غاز في الخليط يذوب كما لوكان بمفرده.
(7) كـمـيـة الـغـاز المذابة تـعـتـمـد على الضغط الجـزئـي للـغـاز فـوق المحلول وليس على ضغوط الغازات الأخرى إن وجدت.
(8) إذا كان لدينا غاز واحد في ظروف مختلفة وعند درجة حرارة ثابتة:
فإنه للغاز الأول : C1 = K P1
فإنه للغاز الثاني :C2 = K P2
وبقسمة معادلة الغاز الثاني على معادلة الغاز الأول ينتج القانون التالي:
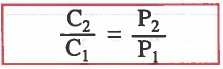
C1 = تركيز الغاز في الحالة الأولى
C2 = تركيز الغاز الثاني في الحالة الثانية
P1 = الضغط الجزئي للغاز في الحالة الأولى
P2 = الضغط الجزئي للغاز في الحالة الثانية
أمثلة محلولة على قانون هنري
مثال (1): إذا فرض أن ذائبية غاز الأكسجين في الماء mol / L 104 × 2.7 عند سطح البحر وعند 20oC فاحسب الضغط الجزئي لغاز الأكسجين عند نفس الظروف علماً بأن ثابت هنري g / L . atm 10-3 × 1.3
الحل:
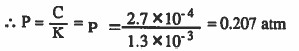
مثال (2): تبلغ ذائبية غاز النيتروجين g / L 10-2 × 3.4 عند ضغط قدره atm 1 ودرجـة حـرارة احسب تـركـيـز نـفس الـغـاز عند 15cm.Hg ثم احـسـب تـركـيـز غـاز النيتروجين بوحدة mol / L
الحل:
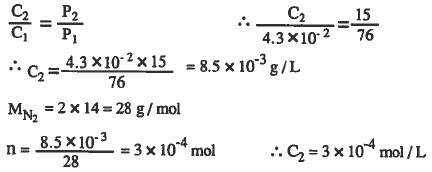
مثال (3): يذوب غاز الأكسجين المجمع فـوق الماء عند ضغط كلي قدره 1atm ودرجة حرارة 25oC بمقدار 0.0393g / L . ما مقدار ذوبانه في الماء عندما يكون ضغطه الجزئي فوق الماء 800torr علما بان الضغط الجزئي للماء 24torr عند 25oC
الحل: