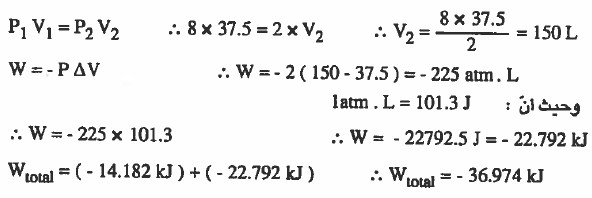قبل البدء فى قراءة المسائل يرجي مراجعة هذا الموضوع : شرح القانون الأول للثرموديناميك بالتفصيل
مسائل محلولة على القانون الأول للديناميكا الحرارية
مثال (1): عند درجة حرارة ثابتة ، اكتسب غاز كمية حرارة مقدارها لـ 40 فتمدد الغاز وبذل شغلاً على المحيط مقداره 120J
(۱) احسب التغير في الطاقة الداخلية للنظام .
(۲) احسب التغير في الطاقة الداخلية للمحيط .
الحل:
(۱) قيمة (q) بالموجب ، وذلك لأن النظام يكتسب حرارة من المحيط.
قيمة (W) بالسالب ، وذلك لأن النظام يعمل شغلاً على المحيط ، وذلك لازدياد حجمه.
ΔE = q + W
ΔE = (+40) + (-120) = - 80 J
نلاحظ أن قيمة ΔE بالسالب وهذا يعني أن الطاقة الداخلية للنظام قلت بمقدار 80J
(۲) قيمة (q) بالسالب ، وذلك لأن المحيط فقد حرارة
قيمة (W) بالموجب ، وذلك لأنه النظام عمل شغل على المحيط .
ΔE = q + W
ΔE = (- 40) + (+120) = + 80 J
لاحظ قيمة ΔE بالموجب وهذا يعني أن الطاقة الداخلية للمحيط زادت بمقدار 80J
من (۱) و (۲) النظام تنقص طاقـتـه الداخلية بمقدار 80J ، وتزداد الطاقة الداخلية للمحيط بمقدار80J ، وهذا يؤيد قانون حفظ الطاقة
مثال (2): إذا ضغط 500ml من غـاز مـا وأصبح حجمه 250ml تحت ضغط خارجي ثابت قدره 3atm ، وإذا امتص الـغـاز 12.6kJ فـمـا هـي قـيـمـة كل من: ΔE , W , q للغاز المضغوط بالكيلو جول . ( 1L atm = 101.3J)
الحل:

مثال (3): إذا بذل غاز شغلاً على المحيط الخارجي قدره 15J فاحسب كمية الحرارة (q) إذا كان قيمة التغير في الطاقة ΔE هي 20J - .
الحل:
قيمة W بالموجب ، وذلك لأن النظام يعمل شغلاً على المحيط.
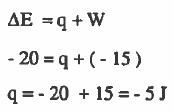
نلاحظ ان قيمة (q) بالسالب وهذا يعني أن النظام فقد طاقة-.
نلاحظ أن قيمة ΔE بالسالب وهذا يعني أن الطاقة الداخلية للنظام قلت بمقدار 20J
مثال (4): سمح لغاز مثالي حـجـمـه 300L ضغطه 2atm بأن يتمدد ضد ضغط خارجي قدره 0.75atm احسب الشغل الذي يبذله الـغـاز بوحدة الكيلو جـول ، افرض ان التمدد أيسوثيرمي فما قيمة (q) للغاز
الحل:

مـثـال (5): سمح لـغـاز مـثـالـي حـجـمـه 20L وضغطه 15atm بأن يـتـمـدد على مرحلتين الأولى كان الضغط الخارجي قدره 8atm وفي المرحلة الثانية كان الضغط الخارجي 2atm أحسب الشغل الذي يبذله الغاز بوحدة الكيلو جول. (latm. L = 101.3J)
الحل:
لاحظ أن الضغط الداخلي يساوي 15atm والضغط الخارجي في المرحلة الأولى يساوي 8atm ، وهذا يعني أن الغاز سوف يتمدد (يزداد الحجم) حتى يصبح ضغط الغاز يساوي 8atm
وبذلك يمكن استخدام قانون بويل للتوصل إلى حجم الغاز الجديد (بعد التمدد):
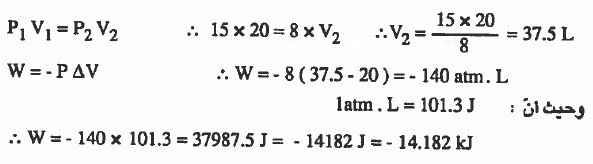
وفي المرحلة الثانية سوف يكون (P2 = 2atm) لذا سوف نستخدم قانون بويل للتوصل إلى حجم الغاز الجديد: