الانتروبي وتلقائية التفاعل
Entropy and Spontaneous Processes
- يهـتـم علـم الثـرمـوديناميك (الديناميكا الحرارية) بدراسة تلقائية العمليات الكيميائية.
التغيرات التلقائية Spontaneous Processes
- تعريف العملية التلقائية: هي تلك العملية (فيزيائية أو كيميائية) التي تحدث تلقائياً دون تأثير من أي عامل خارجي.
التغيرات الكيميائية التلقائية
- من التغيرات الكيميائية التلقائية تفاعل الصوديوم مع الماء يعتبر تفاعلاً تلقائياً حيث ينتج هيدروكسيد الصوديوم وغاز الهيدروجين.
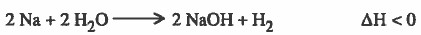
- ولا يمكن أن يحدث العكس أي يتـفـاعـل هيدروكـسـيـد الصـوديـوم مع الهيدروجين لينتج الصوديوم والماء.
التغيرات الفيزيائية التلقائية
- من التغيرات الفيزيائية التلقائية ما يلي:
- من الأمثلة السابقة لنا أن المواد أو الاجسام تسعى للوصول إلى وضع أقل طاقة (أكثر استقرار) أي طاقة النواتج أقل من طاقة المتفاعلات.
- من هذا المفهوم هل يمكن أن نقول أن أي تفاعل تلقائي يجب أن يكون طارد للحرارة؟ الإجابة بلا ، وذلك لأن هناك بعض التغيرات الفيزيائية أو الكيميائية ماصة للحرارة ( أي يصاحبها زيادة في المحتوى الحراري) ومع ذلك تحدث تلقائياً ، فمثلاً:
(1) تفكك أكسيد الزئبق:
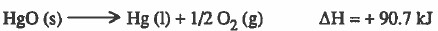
(2) تبخر الماء السائل:
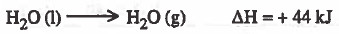
نستنتج مما سبق أن التغير في المحتوى الحراري (الإنثالبي) لا يمكن من خلاله الاستدلال على تلقائية التفاعل لذلك لجا العلماء لخاصية ثرموديناميكية وهي الانتروبي (S).
الانتروبي (S) Entropy
- تعريف الانتروبي: هو مقياس للعشوائية أو عدم الترتيب.
- والمقصود من مفهوم الانتروبي أن المواد مثلاً عندما يحدث لها تغيرات فيزيائية أو كيميائية فإنها تسعى تلقائياً للوصول العشوائية (عدم الانتظام) ، وكلما زادت العشوائيـة (عدم الانتظام) تزداد قيـمـة الانتروبي.
- فمثلاً يتحول الماء من الحالة السائلة إلى الحالة الغازية تلقائياً وذلك لزيادة العشوائية (من المعلوم أن الطاقة الحركية للغازات اعلى من السوائل).
- نستنتج مما سبق أن العمليات أو التغيرات تحدث تلقائياً إذا صاحبها واحد أو اثنان من التغيرات التالية:
- تغير نحو إنثالبي أقل.
- تغير نحو حالة عشوائية (عدم انتظام أكثر) أي زيادة في الانتروبي .
- ملاحظة: عادة تتجه الأشياء المنتظمة نحو عدم الانتظام ، بينما لا تتجه الأشياء غير المنظمة من تلقاء نفسـهـا نحو الانتظام ، ففي المواد الصلبة تكون الجزيئات منظمـة اكـثـر من المواد السائلة ، والمواد السائلة تكون منظمة أكثر من المواد الغازية.
- وهذا يفسر الكثير من العمليات التي تحدث تلقائياً مع أنه يصاحبه زيادة في الإنثالبي ، فمثلاً:
العمليات التلقائية المصاحبة لزيادة الإنثالبي
(أ) تفكك أكسيد الزئبق يحدث تلقائياً مع أن التفاعل يصاحبه زيادة في الإنثالبي
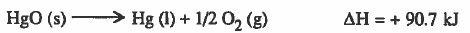
ويمكن تفسير ذلك بأن جزيئات (l) O2(g) , Hg أكثر عشوائية (أقل انتظاماً) من جزيئات أکسيد الزئبق الصلبة.
(ب) تفكك نترات الأمونيوم في الماء يحدث تلقائياً مع أن الذائبية يصاحبها زيادة في الإنثالبي
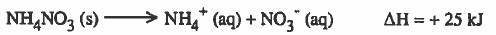
ويمكن تفسير ذلك بان ايونات -NH4+ , NO3 أكثر عشوائية (أقل انتظاماً) من بلورات نترات الأمونيوم الصلبة.
(جـ) تحول الماء من الحالة السائلة إلى الحالة الغازية تحدث تلقائياً مع أن العملية يصاحبها زيادة في الإنثالبي
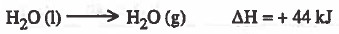
- ويمكن تفسير ذلك بأن الماء في الحالة الغازية أكثر عشوائية (أقل انتظاما ) من الماء في الحالة السائلة.
ملاحظات مهمة عن الانتروبي
ولذلك يمكن أن نخرج بالقاعدة التالية :
(S(s) < S(l) < S(g
S(s) : انتروبي المادة الصلبة
S(l) : انتروبي المادة السائلة
S(g): انتروبي المادة الغازية
مثال توضيحي : SH₂O(l) = 69.6 kJ & SH₂O(g) = 188.7 kJ
- نستنتج مما سبق أن الاتجاه المفضل للتغيرات الفيزيائية أو الكيميائية هو الاتجاه الذي تزداد فيه درجة العشوائية (عدم الانتظام) (الانتروبي).
- بمعنى ان التغير في الانتروبي الكلي ΔS هو الذي يحدد كون العملية تلقائية أم لا .
الإنتروبي يعتبر دالة حالة
لأنه يعتمد على حالة النظام النهائية والابتدائية بغض النظر عن الطريقة التي حدث بها التغير.
- ويمكن توضيح ذلك كما يلي:
ΔSs = Sf - Si
حيث أن:
ΔSs: التغير في الانتروبي للنظام
Sf: انتروبي النظام في الحالة النهائية
Si: انتروبي النظام في الحالة الابتدائية
- ليس كل تفاعل تلقائي سريع لأن هناك تفاعلات تلقائية وبطيئة في نفس الوقت ، مثل صدأ الحديد.