مقدمة عن سرعة التفاعل Rate of reaction
تبين لنا من خلال دراسة الثرموديناميك أنه عندما تكون قيمة ΔG بالسالب فإن هذا يعني أن التفاعل يحدث تلقائياً ، ولكن تبين بعد ذلك أن هناك تفاعلات قيمة ΔG لها بالسالب ومع ذلك لا تحدث في الظروف العادية فمثلاً:
(أ) تفاعل الألماس مع الاكسجين :
C (diamond) + O2 (g) → CO2 (g)
ΔG = -79 kJ/mol
لاحظ ان قيمة ΔG بالسالب أي أن التفاعل يحدث تلقائياً ، ومع ذلك فإن الألماس لا يتفاعل مع الاكسجين إلا عند درجات حرارة مرتفعة.
(ب) صدأ الحديد
4Fe (s) + 3O2 (g) → 2 F2O3 (s)
ΔG= - 742.2 kJ/mol
لاحظ أن قيمة بالسالب أي أنه يفترض أن يحدث التفاعل تلقائياً عند درجات حرارة عادية ومع ذلك فإن صدأ الحديد بطيء جداً وتزداد سرعة التفاعل في وجود بخار الماء.
فعلم الديناميكا الحرارية (الثرموديناميك) يحكم فقط على تلقائية التفاعل ، ولكنه لا يتعرض لشروط بدء التفاعل ولا لسرعة التفاعل ، ولذلك كان لا بد من دراسة سرعة التفاعل والظروف المحيطة بالتفاعل الكيميائي.
تعريف سرعة التفاعل Rate of reaction
- تعريف سرعة التفاعل ، هو معدل النقص في تركيز إحدى المواد المتفاعلة أو الزيادة في تركيز إحدى المواد الناتجة خلال فترة زمنية معينة.
مثال توضيحي
بالنسبة للتفاعل التالي:
H2+ I2 → 2 HI
عند حدوث هذا التفاعل سوف يتناقص تركيز اليود I2 وتركيز الهيدروجين H2 وفي نفس الوقت يزداد تركيز يوديد الهيدروجين HI ، لاحظ الرسم التالي :
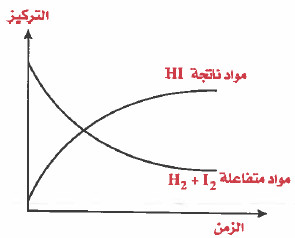
علل : تقل سرعة التفاعل كلما مر زمن أطول على التفاعل عند درجة حرارة ثابتة.
السبب : وذلك لأنه مع مرور الزمن على التفاعل تتناقص تراكيز المتفاعلات ، ونقص التراكيز يؤدي إلى نقص سرعة التفاعل .
كما لاحظت أنه عند حدوث تفاعل كيميائي فإن تراكيز المتفاعلات تتناقص مع مرور الزمن ، وتزداد تراكيز النواتج ، وهذه الظاهرة يمكن الاستفادة منها في قياس معدل سرعة التفاعل .
معدل سرعة التفاعل Average of Reaction Rate
- يمكن حساب معدل سرعة التفاعل بقسمة التغير في تركيز إحدى المواد المتفاعلة أو الناتجة مقسوماً على الزمن الذي حصل فيه التغير.
مثال : حسب التفاعل التالي :
A → B

والمقصود بمعدل سرعة التفاعل هو كمية المواد المتفاعلة التي تتم في زمن معين.
- ويستفاد من معرفة معدل سرعة التفاعل في أوقات مختلفة في معرفة ومتابعة مسار التفاعل.
قاعدة عامة
حسب التفاعل التالي:
aA + bB → cC + dD
- يمكن قياس سرعة التفاعل السابق بدلالة اختفاء المواد المتفاعلة وتكوين المواد الناتجة كما يلي:
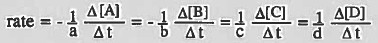
- ويمكن الاستفادة من المعادلة السابقة في الحصول على معدل سرعة التفاعل لمادة ما في التفاعل بمعرفـة مـعـدل سـرعـة التفاعل لمادة أخري في نفس التفاعل وذلك بقسمة معدل سرعة التفاعل لكل مادة على معاملها في المعادلة الموزونة.
ملاحظة:
- التغير في تركيز المواد المتفاعلة تكون إشارته بالسالب ، والإشارة السالبة تعني أن تركيز المادة يتناقص مع الزمن.
- أما التغير في تركيز النواتج تكون إشارته بالموجب، والإشارة الموجبة تعني أن تركيز المادة يزداد مع الزمن.
- وبصفة عامة فإن وجود الإشارة السالبة يجعل النتيجة النهائية موجبة .
- وفي حالة وجود قيم معدل سرعة التفاعل جاهزة يمكن استخدام القانون:
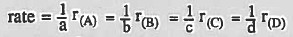
لاحظ أن إشارة معدل سرعة التفاعل دائما موجبة.