تعريف سرعة التفاعل Rate of reaction
- تعريف سرعة التفاعل ، هو معدل النقص في تركيز إحدى المواد المتفاعلة أو الزيادة في تركيز إحدى المواد الناتجة خلال فترة زمنية معينة.
- يمكنك قراءة موضوع شامل عن سرعة التفاعل: ما هي سرعة التفاعل ؟ وما هو معدل سرعة التفاعل؟
مسائل محلولة على سرعة التفاعل Rate of reaction
مثال (1): كيف يمكن حساب معدل سرعة التفاعل للتفاعل التالي :
(g) 4NH3 (g) + 3O2 (g) → N2 (g) + 6 H2O
بمعلومية اختفاء المواد المتفاعلة وتكون المواد الناتجة لكل مادة على حدة ثم قارن سرعة التفاعل لكل مادة من المواد في المعادلة
الحل:
يمكن قياس معدل سرعة التفاعل الأول بإحدى الطرق التالية:

ويمكن مقارنة معدل سرعة التفاعل لكل مادة مع المواد الأخرى:
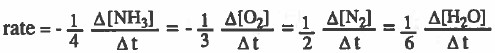
ملاحظة : ولكي تكون معدل سرعة التفاعل متساوية قسمنا على المعاملات حتى نفس معدل سرعة التفاعل .
مثال (2): كيف يمكن قياس سرعة التفاعلات التالية بدلالة اختفاء وتكوين المواد الناتجة:
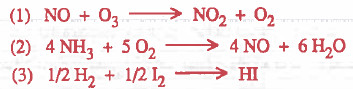
ويمكن صياغة السؤال السابق بصيغ مختلفة فمثلاً:
- اكتب التعبير الرياضي لمعدل كل من التفاعلات التالية
- ما علاقة معدل سرعة التفاعل للمواد التالية بعضها مع بعض لكل معادلة على حدة
- اكتب معادلة سرعة التفاعل لكل من التفاعلات التالية.
الحل:
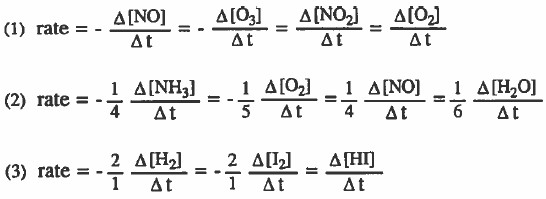
معلومة: يمكن التعبير عن التغير في التركيز بإحدى الصيغتين التاليتين : [A]d أو [A]Δ
مثال (3): حسب التفاعل التالي:
A+ 2B → C
وبعد إجراء التجربة عند درجة حرارة ثابتة حدث تغير في تركيز المادة A مع مرور الزمن وظهرت النتائج المبينة في الجدول التالي:
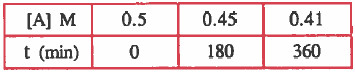
(1) احسب معدل اختفاء المادة A من بداية التفاعل وحتى مرور min 180
(2) احسب معدل اختفاء المادة A في الفترة الزمنية من min 180 وحتى min 360 .
(3) قارن بين معدل سرعة التفاعل في الفقرة (1) والفقرة (٢) .
(4) احسب معدل استهلاك المادة (B) بمعلومية معدل استهلاك المادة (A) في الفترة الزمنية من (min 180 - 0) .
الحل:
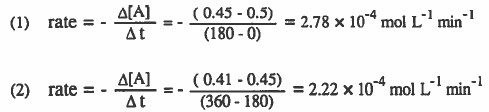
ملاحظات:
(أ) يبدو أنك لاحظت أهمية الإشارة السالبة الموجودة أعلاه وذلك حتى تكون قيمة سرعة التفاعل موجبة في النهاية.
(ب) لاحظ أنه يمكن أن تكون وحدة سرعة التفاعل:
مول / لتر × ثانية ( 1-mol L-1 min ) أو مولار / ثانية ( 1-M min )
(3) عند مقارنة النتائج في الفقرة (1) مع الفقرة (۲) نجد أن سرعة التفاعل نقصت وهذه نتيجة منطقية، حيث أن تركيز المواد المتفاعلة سوف يقل مع مرور الزمن وبذلك سوف تقل سرعة التفاعل.
(4)
