علاقة تركيز المواد المتفاعلة بسرعة التفاعل الكيميائي
- غالبا كلما زاد تركيز المواد المتفاعلة تزداد سرعة التفاعل.
- فإذا كان لدينا تفاعل من الرتبة (الدرجة) الأولى :
AB → A +B
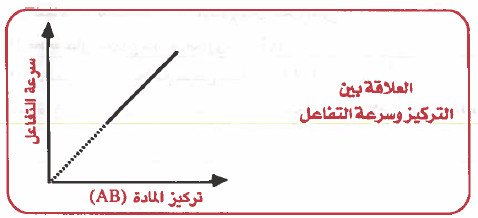
- نلاحظ من الرسم أن سـرعـة الـتـفـاعـل تزداد بازدیاد تركيز المادة (AB) ، ونلاحظ أيضاً أن سرعة التفاعل تكون صفراً عندما يكون تركيز المادة يساوي صفر.
- ملاحظة : عند دراسة أثر التركيز على سرعة التفاعل يجب تثبيت العوامل الأخرى مثل طبيعة المواد المتفاعلة ودرجة الحرارة والضغط .
- ويمكن من خلال دراسة اثر التركيز على سرعة التفاعل التوصل لقانون سرعة التفاعل
- ويتم التعبير عن التركيز بطريقتين وهما :
(1) المولارية في حالة المحاليل السائلة.
(2) الضغط الجزئي في حالة الغازات.
مسائل محلولة
(أ) : أيهما أسرع تفاعلاً :
(1) تفاعل محلول HCl تركيزه (0.1M) مع محلول NaOH ترکیزه (0.1M)
(2) تفاعل محلول HCl تركيزه (0.2M) مع محلول NaOH ترکیزه (0.1M)
جواب :
التفاعل الثاني أسرع لأن تركيز حمض الكلور فيه أكبر.
(ب) علل: شرب الماء كثيراً مع الطعام يعيق عملية الهضم.
السبب: وذلك لأن الماء يؤدي إلى تخفيف تركيز المواد المسئولة عن الهضم ، ونقص التركيز يؤدي إلى نقص سرعة التفاعل.
المسئولة عن الهضم ، ونقص التركيز يؤدي إلى نقص سرعة التفاعل.
(جـ): أي التفاعلات الثانية متجانسة وايها غير متجانسة:
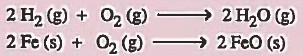
جواب:
التفاعل الأول متجـانس لأن جميع المواد في التفاعل في حالة غازية (متجانسة).
والتفاعل الثاني غير متجانس لأن حالات المواد في التفاعل مختلفة (غير متجانسة).