مثال (4): إذا كان ثابت سرعة تفكك غاز (N2O5) هو 2-10×3.2 min-1 فاحسب الزمن اللازم لخفض تركيزه من ( 0.03M ) إلى ( 0.003M) بوحدة (min) .
الحل:
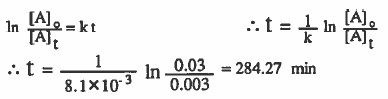
مثال (5): تتفكك مادة معينة تفككاً من الرتبة الأولى ، فإذا استغرق تغير تركيزها من (0.705mol / L) إلى (0.173mol / L) أربع دقائق ، فـاحـسب ثابت سرعـة الـتـفـاعل بوحدة S-1
الحل:
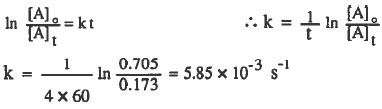
مثال (6): إذا علمت أن تفكك (C2H5Cl) تفـاعـلاً مـن الرتبة الأولى وكـان تـركـيـز (C2H5Cl) بعد مرور دقيقة واحدة هو (0.01mol / L) . فما التركيز الابتدائي لهذه المادة ؟ علما بان (s 22 = t1/2)
الحل:
نوجد في البداية قيمة ثابت سرعة التفاعل بمعلومية نصف العمر:
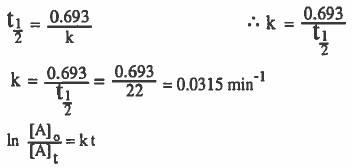
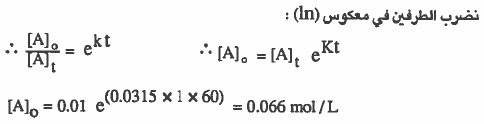
مثال (7): يتفكك كلوريد الإيثيل عند درجة حرارة معينة حسب التفاعل:
C2H5Cl → C2H4 + HCl
فإذا علمت أن ثابت سرعـة الـتـفـاعـل يساوي 2-10×3.2 s-1 والتـركـيـز الابتدائي لكلوريد الإيثيل يساوي ( 0.165mol . L-1) .
(۱) ما رتبة التفاعل ؟
(۲) ما تركيز C2H5Cl بعد مضي (125h) ؟
(۳) ما نصف العمر للتفاعل .
الحل:
(۱) بما أن وحدة ثابت سرعة التفاعل (s-1) فيكون التفاعل من الرتبة الأولى.
(۲)

سؤال: كيف يمكن تفسير اثر العوامل المختلفة على سرعة التفاعل.
جـواب:
وضع الـعـلـمـاء نظريتـان لـتـفـسـيـر اثـر الـعـوامل المختلفة على سرعة التفاعل وهي:
(۱) نظرية التصادم
(۲) نظرية الحالة الانتقالية