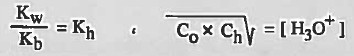الأملاح الحامضية Acidic salts
- يسمى ملح من النوع الثاني Salt from the Sacond kind
- هذا الملح هو ملح حامضي لأنه ينتج من تفاعل حمض قوي وقاعدة ضعيفة.
- هي أملاح ذات أثر حامضي أي أن ( 7 > pH ) .
- عندما تذوب في الماء فإنها تتفكك إلى أيونات موجبة وسالبة ، حيث يتميأ الأيون المشتق من القاعدة الضعيفة ( تتفاعل مع الماء ) لتنتج ايونات الهيدرونيوم وبالتالي يكتسب المحلول الصفة الحمضية .
- الملح الحامضي : هو ملح ناتج عن تفاعل حمض قوي وقاعدة ضعيفة .
مثال للتوضيح
- ومن الأمثلة المعروفة على هذا النوع من الأملاح ملح كلوريد الأمـونـيـوم NH4Cl وهو ناتج عن تفاعل حمض الكلور HCl (حمض قوي) والأمونيا NH3 (قاعدة ضعيفة) كما في المعادلة :
HCI + NH3 → NH4Cl
وعند إذابة هذا الملح في الماء يتفكك إلى أيونات:
-NH4Cl → NH4+ + Cl
وهنا يتميأ فقط الأيون المشتق من أصل ضعيف وهو أيون الأمونيوم (+NH4) المشتق من النشادر (قاعدة ضعيفة) ، حيث تتفاعل أيونات الأمونيوم مع الماء لتنتج أيونات الهيدرونيوم
+NH4Cl + H2O → NH3 + H3O
قانون ثابت الاتزان هو:
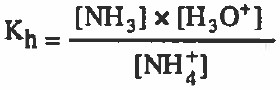
حيث أن : Kh = ثابت التميؤ
قوانين تميؤ الأملاح الحامضية
في هذه الحالة نستخدم القوانين التالية التي يمكن استنتاجها بطريقة رياضية:
بالنسبة لمحاليل الأملاح الحمضية:
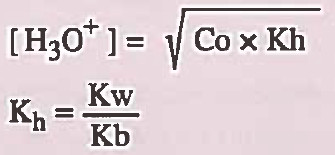
Co = التركيز الأصلي للملح الحامضي
Kh = ثابت التميؤ ( ثابت تفكك الأيون الموجب ) ويمكن الرمز له بـ Ka
مثال:
+NH4+ + H2O → NH3 + H3O
Kh (NH4+) = 5.6 x 10-10
+NH4+ + H2O → NH3 + H3O
Ka (NH4+) = 5.6 x 10-10
ملاحظات هامة قبل حل المسائل على الأملاح الحامضية
بعض الأحماض القوية
حمض الكلور (HCl) - حمض النيتريك (HNO3)
بعض القواعد الضعيفة
نشادر (أمونيا) (NH3) - ميثيل أمين (CH3NH2) - إيثيل امين (C2H5NH2) - أنيلين ( C6H5NH2 )
- أمثلة على تكوين الأملاح الحمضية من الحمض القوي والقاعدة الضعيفة :
(1) ملح كلوريد الأمونيوم NH4Cl
HCl + NH3 → NH4Cl
(2) ملح نترات الأمونيوم NH4NO3
HNO3 + NH3 → NH4NO3
(3) ملح كلوريد ميثيل الامونيوم CH3NH3Cl
CH3NH2+ HCl→ CH3NH3Cl
(4) ملح كلوريد إيثيل الأمونيوم C2H5NH3Cl
C2H5NH2+ HCl → C2H5NH3Cl
- وجميع هذه الأملاح ينطبق عليها القوانين التالية: