معادلة شردونجر الموجية
- فى عام 1926م تابع الفيزيائي النمساوي إيروين شرودنجر نظريم الموجة - الجسيم التى اقترحها دي برولي، واشتق شرودنجر معادلة على اعتبار أن إلكترون ذرة الهيدروجين موجة.
- وظهر أن نموذج شرودنجر لذرة الهيدروجين ينطبق جيدًا على ذرات العناصر الأخرى، وهو ما فشل نموذج بور فى تحقيقه
- يسمى النموذج الذري الذي يعامل الإلكترونات على أنها موجات بالنموذج الموجي الميكانيكي للذرة أو النموذج الميكانيكي الكمي للذرة. وكما هو
- إعتبر كل حل من لمعادلة شرودنجر يمثل دالة موجية، ترتبط مع احتمال وجود الإلكترون ضمن حجم معين من الفراغ حول النواة.
موقع الإلكترون المحتمل
- تتنبأ دالة الموجة بمنطقة ثلاثية الأبعاد للألكترون حول النواة تسمي المستوى وهو يصف الموقع المحتمل لوجود إلكترون.
- يشبه المستوى الفرعي سحابة تتناسب كثافتها عند نقطة معينة مع احتمال وجود الإلكترون عند تلك النقطة.
- يوضح الشكل التالي خريطة الكثافة الإلكترونية (السحابة الإلكترونية) التى تصف الإلكترون فى مستوى الطاقة الإدنى ، كما أنها تُعد صورة لحظية لحركة الإلكترون حول النواة، حيث تمثل كل نقطة فيها موقع الإلكترون عند لحظة معينة من الوقت.
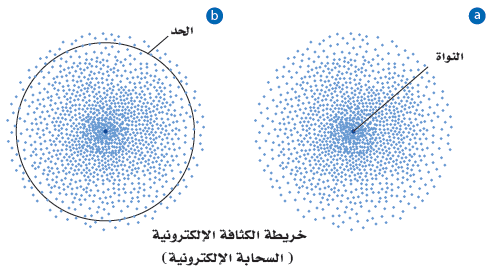
فى الشكل (a): تظهر الكثافة العالية للنقاط قرب النواة أن احتمال وجود الإلكترون قرب النواة كبير جداً.
فى الشكل (b): يحتمل وجود الإلكترون بنسبة 90% ضمن المنطقة الدائرية الظاهرة عند أى لحظة وأحياناً يتم أعتبار هذة المنطقة تمثيلاً لحدود الذرة.
وتمثل الكثافة العالية للنقاط قرب النواة احتمالاً كبيراً لوجود الإلكترون في هذا الموقع إلا أنه - بسبب عدم وجود حدود ثابتة للسحابة - من الممكن أيضًا أن يوجد الإلكترون على مسافة أبعد من النواة.