أعداد الأكسدة Oxidation Number
تعريف أعداد الأكسدة:
- هو عدد الإلكترونات التي يمكن ان يفقدها أو تكتسبها أو تساهم بـهـا ذرة العنصـر خـلال التفاعل.
- وفي المركـبـات الـتـسـاهـمـيـة هي الشحنة التي تحملها الذرة لوحدنا إلكترونات الروابط التساهمية للذرة الأكثر سالبيه كهربية.
قواعد أعداد الأكسدة
(1) عدد الأكسدة للعنصر النقي (الحر) غير المرتبط بغيره (ذرة أو جزيء) يساوي صفراً.
أمثلة:
Na , Ag , Cu , H2 , Cl2 , O2 , S8
(2) عدد الأكسدة للأيونات أحادية الذرة يساوي شحنتها.
أمثلة:

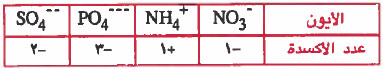
(3) مجموع أعداد الأكسدة لجميع الذرات في أيون يجب أن تساوي الشحنة الموجودة على ذلك الأيون.
أمثلة:
(4) مجموع أعداد الأكسدة لجميع الذرات في مركب متعادل (لا يحمل شحنة) يساوي صفراً
أمثلة:
H2O , NO2 , NaBrO3 , H2SO4
(5) عدد الأكسدة لعناصر مجموعة الفلزات القلوية (1A) في مركباته تساوي (1+) .
أمثلة على الفلزات القلوية : ( Rb , K , Na , Li )
(6) عدد الأكسدة لعناصر مجموعة الفلزات القلوية الأرضية (2A) في مركباته تساوي (2+)
امثلة على الفلزات القلوية الأرضية: ( Ba , Mg , Ca )
(7) عدد الأكسدة لعناصر المجموعة السابعة (الهالوجينات) غالبا تساوي (1-)
أمثلة على الهالوجينات: ( F , Cl , Br , I )
أما إذا ارتبط الهالوجين بذرة ذات سالبية كهربية أعلى منه مثل الأكسجين فإن عدد أكسدة الهالوجين سوف يأخذ عدد أكسدة موجب
مثل:
Cl2O عدد أكسدة الكلور = 1+
HClO3 عدد أكسدة الكلور = 5+
حساب عدد الأكسدة لذرة معينة في مركب
يحسب عدد الأكسدة لذرة عنصر داخل جزيء أو أيون حسب أعداد الأكسدة للعناصر الأخرى المشتركة معه كما يلي:
(1) عدد الأكسدة للهيدروجين في جميع مركباته هو (1+)
باستثناء هيدريدات الفلزات مثل هيدريد الصوديوم (NaH) وهيدريد الكالسيوم (CaH2) وعدد الأكسدة له (1-)
(2) عند الأكسدة للأكسجين في جميع مركباته هو (2-)
باستثناء:
(أ) مركبات فوق الأكاسيد مثل فوق أكسيد الهيدروجين (H2O2) وفوق أكسيد الصوديوم (Na2O2) وفوق أكسيد البوتاسيوم (K2O2) وفوق أكسيد الكالسيوم (CaO2) ، وعـدد الأكسدة للأكسجين فيها يساوي (1-)
(ب) مركب فلوريد الأكسجين OF2 ، وعدد الأكسدة للأكسجين فـيـه بالموجب (2+) ، لأن السالبية الكهربية للفلور اعلى من الأكسجين.
(جـ) مرکب سوبر أكسيد البوتاسيوم KO2 ، عدد الأكسدة للأكسجين فيه (-)
مسائل محلولة على أعداد التأكسد
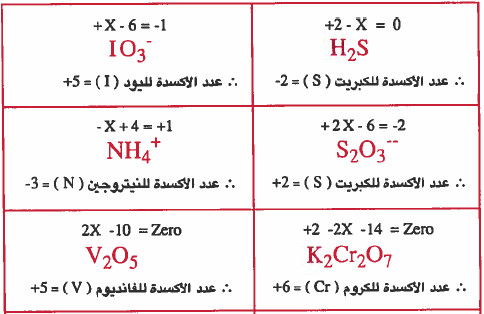
مثال (1): احسب عدد الأكسدة للذرات التي باللون الأحمر في المركبات أو الأيونات التالية:
K2Cr2O7 , NH4+ , S2O3-- , IO3- , H2S , OF2
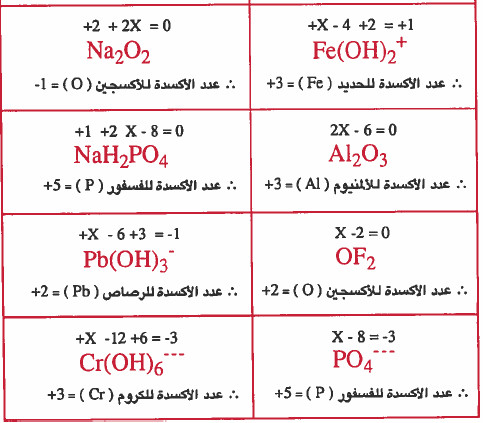
+NaH2PO4 , Al2O3 , Na2O2 , Fe(OH)2
V2O5 , Cr(OH)63- , PO43-, Pb(OH)3
الحل: