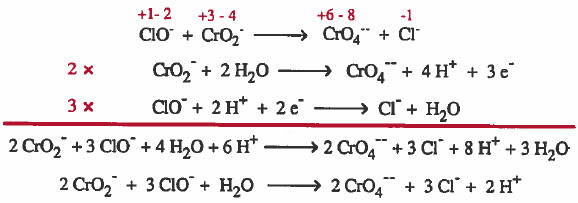طريقة الأيون - إلكترون أو نصف التفاعل
Electron or Half Reaction Method
يمكن وزن معادلات الأكسدة والاختزال بطريقة نصف التفاعل حسب الخطوات التالية:
الخطوة (1): إيجاد الأكسدة لجميع الذرات في المعاملة ، ومن هنا سوف يتبين العنصر الذي تأكسد والعنصر الذي اختزل.
الخطوة (2): وزن الذرات التي حصل لها واختزال من خلال مقارنة اعداد الأكسدة للذرات. وإذا كانت هذه الذرات موزونة ننتقل للخطوة التالية مباشرة .
الخطوة (3): كتابة نصفي تفاعل الأكسدة والاختزال كل على حدة.
الخطوة (4): وزن الأكسجين ، وذلك بإضافة جزيء ماء عن كل ذرة أكسجين ناقصة.
الخطوة (5): وزن الهيدروجين كما يلي:
- في الوسط الحمضي يوازن النقص في ذرات الهيدروجين بإضـافـة أيون هيدروجين (+H) عن كل ذرة هيدروجين ناقصة.
- في الوسط القاعدي يوازن النقص في ذرات الهيدروجين بإضافة جزيء ماء H2O كل ذرة هيدروجين ناقصة وفي الجهة الأخـرى يضاف أيون هيدروكسيد (-OH)عن جزيء ماء تمت إضافته.
الخطوة (6): نوازن الشحنات وذلك بإضافة إلكترونات إلى كل نصف على حدة.
الخطوة (7): توحـيـد عـدد المعامل الحسابي للإلكترونات.
- في حالة عدم تساوي الإلكترونات المفقودة مع المكتسبة بحيث نضرب كل نصف تفاعل في عدد بحيث اعداد الإلكترونات المفقودة والمكتسبة
الخطوة (8): نجمع نصفي التفاعل بعد التخلص من الإلكترونات في كلا المعادلتين.
الخطوة (9): اختصار المتكرر في الطرفين وجد
مسائل محلولة على وزن معادلات الأكسدة والاختزال بطريقة نصف التفاعل
مثال (1): زن المعادلة التالية في وسط حمضي بطريقة نصف التفاعل:
-ClO-+ CrO2→ CrO42- + Cl
الحل:
(1) إيجاد أعداد الأكسدة لجميع الذرات في المعاملة:

(2) الذرات التي حصل لها الأكسدة والاختزال موزونة ولهذا ننتقل للخطوة التالية:
(3) كتابة نصفي تفاعل الأكسدة والاختزال كل على حدة .
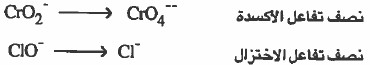
(4) وزن الأكسجين ، وذلك بإضافة جزيء ماء عن كل ذرة أكسجين ناقصة.
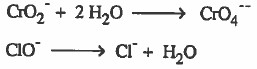
(5) وزن الهيدروجين بإضافة أيون هيدروجين (+H) عن كل ذرة هيدروجين ناقصة.
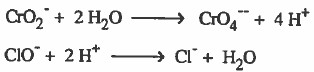
(6) نوازن الشحنات وذلك بإضافة إلكترونات إلى كل نصف على حدة .
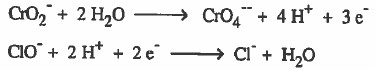
(7) توحـيـد عـدد المعـامـل الـحـسـابي للإلكترونات في حـالـة عـدم تساوي عـدد الإلكترونات المفقودة مع المكتسبة بحيث نضرب كل نصف تفاعل في عـدد مـا بحيث تتساوى اعداد الإلكترونات المفقودة والمكتسبة .
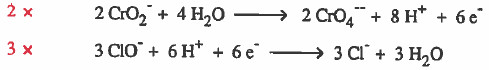
(8) نجمع نصفي التفاعل بعد التخلص من الإلكترونات في كلا المعادلتين.

(9) نختصر المتكرر في الطرفين:

ملاحظات هامة
(1) لقد لاحظت أنه تم وزن المعادلة السابقة بالـتـفـصـيل وتوضيح كل خطوة أثناء الوزن وبذلك ليس ضرورياً ان تكتب جميع الخطوات السابقة عند وزن المعاملة ، ويمكن ضم بعض الخطوات إلى بعض في خطوة واحدة.
(2) ليس ضرورياً عند الحل أن تكتب الخطوات النظرية كان تكتب ( نزن الهيدروجين ) أو ( نختصر المتكرر ) وغير ذلك ، ولقد كتبت الخطوات هنا للشرح ولكي يفهم الطالب كل خطوة.
ويمكن دمج الخطوات السابقة في ثلاث خطوات فقط كما يلي:
أعداد الأكسدة للذرات:
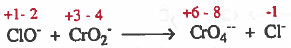
الخطوة (1): نلاحظ أن الذرات موزونة ، لذا ننتقل للخطوة التالية:
الخطوة (2): وتشمل هذه الخطوة على عدة خطوات وهي: كتابة نصفي تفاعل الأكسدة والاختزال ثم وزن الأكسجين ثم وزن الهيدروجين ثم موازنة الشحنات ثم تـوحـيـد عـدد المعامل الحسابي للإلكترونات:
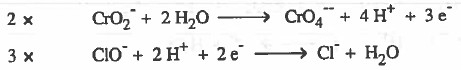
الخطوة (3): بعد التخلص من الإلكترونات في كلا المعادلتين، نجمع نصفي التفاعل ثم نختصر المتكرر في الطرفين:
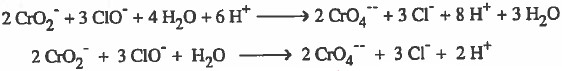
وبذلك يمكن حل المثال السابق بدون كتابة الخطوات النظرية كما يلي: