الخلايا الجلفانية Galvanic Cells
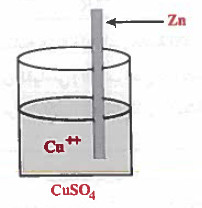
- عندما وضع العلماء قطعة من الخارصين Zn في محلول كبريتات النحاس CuSO4 ذي اللون الأزرق لاحظوا أن قطعة الخارصين تبدأ بالتآكل ويتكون مقابل ذلك على الخارصين طبقة نحاسية ، وأيضا وجد أن لون المحلول الأزرق بدأ يخف مع الزمن.
- وقد تم تفسير ذلك كما يلي:
(1) تآكل الخارصين دلالة على تأكسده وتحوله إلى أيونات ++Zn

(2) خفة لون المحلول الأزرق دلالة على أن أيونات النحاس المسببة للون الأزرق قد نقصت حيث أنها اكتسبت الإلكترونات التي فقدها الخارصين وتحولت إلى نحاس الذي يترسب على قطعة الخارصين:
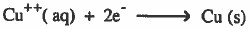
(3) لاحظ العلماء أن التفاعل الذي يحدث به فقد واكتساب إلكترونات يصاحبه انتشار حرارة أي تحول الطاقة الكيميائية إلى طاقة حرارية.
(4) فكر العلماء لماذا لا يستفيدون من هذه الإلكترونات للحصول على التيار الكهربي (طاقة كهربية)
(5) توصل العالم دانيال إلى تصميم خلية جلفانية للاستفادة من التيار الكهربي الناتج من التفاعل ، وسوف نشرح خلية دانيال بالتفصيل كما يلي.
تعريف الخلية الجلفانية
هي خلية يتم فيها تحويل الطاقة الكيميائية إلى طاقة كهربية نتيجة لحدوث تفاعل كيميائي.
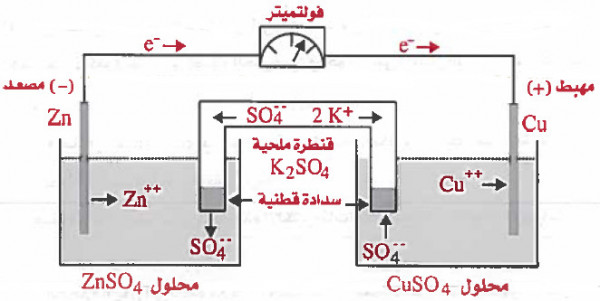
تركيب الخلية الجلفانية (خلية دانيال)
- خلية دانيال هي نموذجاً لأحد الخلايا الجلفانية مكونة من قطب خارصين (Zn) مغمور في محلول كبريتات الخارصين (ZnSO4) ومن قطب نحاس (Cu) مغمور في محلول كبريتات النحاس (CuSO4) ، ويمكن توضيحها كما يلي:
(1) ضع في كأس زجاجي محلول كبريتات الخارصين، واغمس فيه قطب من الخارصين.
(2) ضع في كأس زجاجي محلول كبريتات النحاس ، واغمس فيه قطب من النحاس.
(3) كل إناء يسمى نصف خلية.
(4) صل الأقطاب (الخارصين النحاس) بسلك كهربي بحيث يمر السلك عبر جهاز فولتاميتر (V) وهو جهاز يستخدم لقياس التيار المتولد و معرفة اتجاه التيار.
(5) صل المحلولين بجسر ملحي (قنطرة ملحية) ، وهو عبارة عن أنبوب زجاجي على شكل حرف (U) ، ويحتوي على محلول مركز لمادة أيونية مثل كلوريد البوتاسيوم KCl أو كبريتات البوتاسيوم K2SO4 أو نترات الصوديوم NaNO3.
ماذا يحدث في الخلية الجلفانية
عند إغلاق الدائرة الكهربية فإن:
(1) الخارصين Zn يتأكسد إلى أيونات الخارصين ++Zn التي تهبط في المحلول.

أي أن قطب الخارصين يقل مع الزمن، وتركيز أيونات الخارصين في المحلول تزداد مع الزمن .
أما الإلكترونات الناتجة عن عملية الأكسدة فتنتقل عبر السلك ، وعند مرور هذه الإلكترونات عبر الفولتامتر ينحرف المؤشر ليعطي قيمة التيار المار.
(2) ايونات النحاس Cu++) II) الموجودة في محلول كبريتات النحاس (CuSO4) والملامسة لقطب النحاس تكتسب (تختزل الإلكترونات المارة في السلك الكهربي لتتحول إلى ذرات نحاس وتلتصق بقطب النحاس:
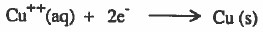
أي أن قطب النحاس يزداد كميته مع الزمن وتركيز ايونات ++Cu تقل مع الزمن في المحلول ، ويظهر ذلك من خلال اختفاء اللون الأزرق تدريجياً.
(3) تستمر هذه العملية (الأكسدة والاختزال) ولكنها بعد زمن تتوقف عندما:
(أ) تنتهي كمية قطب الخارصين Zn الذي يمنح الإلكترونات.
(ب) تنتهي كمية أيونات النحاس Cut التي تستقبل الإلكترونات.
(4) يمكن توضيح التفاعل الكلي كما يلي:
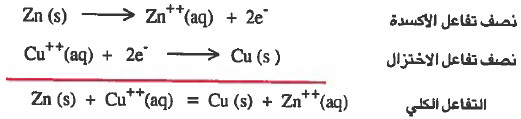
ملاحظات هامة على الخلايا الجلفانية
(1) قطب الخارصين الذي حدث له الأكسدة يسمى مصعد(Anode) وشحنته سالبة وقد تم الاتفاق على أن يوضع المصعد على يسار الخلية.
(2) قطب النحاس والذي حدث عنده عملية الاختزال يسمى مهبط (cathode) وشحنته موجبة ، وقد تم الاتفاق على أن يوضع المهبط على يمين الخلية.
(3) اتجاه حركة الإلكترونات يكون من المصعد ) قطب الأكسدة ) إلى المهبط ( قطب الاختزال ) سواء كان المصعد على اليمين أو اليسار.
(4) يمكن التعبير عن الخلية السابقة كما يلي:
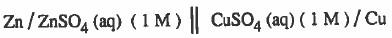
ويمكن كتابتها كما يلي :
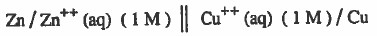
ويمكن كتابتها باختصار كما يلي:
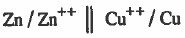
(5) ويمكن تصميم الخلية الكهروكيميائية السابقة بوضع المحلولين في إناء واحد يفصل بينهما حاجز مسامي يسمح بانتقال الأيونات بين المحلولين ولا يسمح بالامتزاج الكامل بين المحلولين ، كما في الرسم التالي:
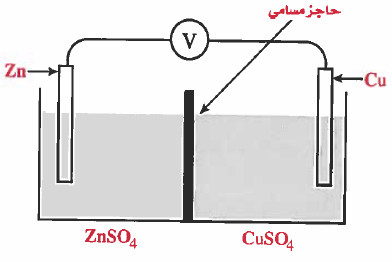
(6) يمكن اختصار الخلية السابقة وذلك بغمس سلك من الخارصين (Zn) في كأس يحتوي على محلول كبريتات النحاس (CuSO4) ، وبعد مضي الوقت سوف يترسب الخارصين.
معلومة:
يحمل المصعد (الأنود) شحنة سالبة لأنه عندما يتأكسد تتولد إلكترونات سالبة تبقى عليه ويحمل المهبط (الكاثود) شحنة موجبة لأن اختزال الأيونات الموجبة إلكترونات سالبة تؤخذ من المهبط .