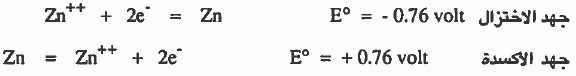جهد الخلية القياسي Standerd Cell Potentials
- في الخلية الجلفانية نلاحظ أن كلا القطبين لديهما قابلية لاكتساب الإلكترونات ، ولكن في النهاية المادة التي تكتسب الإلكترونات هي المادة التي لها ميل أكثر لاكتساب الإلكترونات ، أي الذي جهد اختزال أعلى .
- وهذا يذكرنا بلعبة شد الحبل فكلا الفريقين لديها قابلية لشد الحبل ، ولكن في النهاية سوف يصبح لدينا كاسب وخاسر، بسبب اختلاف قوة الفريقين في الشد .
- في الخلية الجلفانية تنتقل الإلكترونات من القطب السالب (المصعد) إلى القطب الموجب (المهبط) بقوة معينة وهذه القوة تسمى (القوة الدافعة الكهربية) Electromotive Force أو تسمى هذه القوة بجهد الخلية .
تعريف جهد الخلية القياسي ΔEo
- هو مقياس لقدرة الخلية على القيام بجهد كهربي.
- أو هو مقياس لقدرة المواد المتفاعلة على التفاعل عند الشروط القياسية.
- ملاحظة:
يعتبر جهد الخلية قياسياً ويرمز له بـ ΔEo حينما يقاس عند الظروف القياسية:
- تركيز المحلول = 1molar
- درجة الحرارة = 25C°
- الضغط للغازات = 1atm
العوامل المؤثرة في جهد الخلية
(1) تراكيز الأيونات في الخلية.
(2) الضغط الجزئي للغاز المشارك في تفاعلات الخلية.
(3) درجة الحرارة.
دلالة قيمة فرق الجهد للخلية
(1) يدل على قابلية المواد المتفاعلة لتكوين مواد ناتجة.
(2) إذا كان فرق جهد الخلية موجباً كان التفاعل تلقائياً (spontaneous).
أي أن اتجاه الإلكترونات يكون من اليسار إلى اليمين ، أي يحدث التفاعل كما هو مكتوب في المعادلة.
(3) إذا كان فرق جهد الخلية سالباً كان التفاعل غير تلقائي .
أي أن اتجاه الإلكترونات يكون من اليمين إلى اليسار، أي يحدث التفاعل عكس ما هو مكتوب في المعادلة .
(4) لحساب الجهد الناتج عن الخلية نستخدم القانون التالي:

ΔΕo = الجهد القياسي الناتج عن الخلية (عن عملية الاكسدة والاختزال)
ΕoR = جهد القطب الأيمن القياسي (القطب الذي تحدث عنده عملية الاختزال)
ΕoL =جهد القطب الأيسر القياسي (القطب الذي يحدث له الأكسدة)
ملاحظة:
سوف نتفق على أن يكون القطب الذي يحدث له أكسدة على يسار الخلية ، والقطب الذي يحدث عنده الاختزال يكون على يمين الخلية.
(5) إذا عكسنا التفاعل فإن قيمة جهد الخلية تعكس إشارته فقط:
فمثلاً قيمة فرق الجهد للتفاعل التالي:
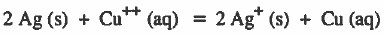
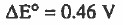
وإذا عكس التفاعل تصبح قيمة فرق الجهد:
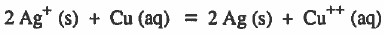
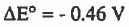
وللمعلومية: