قوانين فاراداي Faraday Laws
- قام فاراداي بدراسة التحليل الكهربي وتوصل للقوانين التي تربط بين كمية الكهرباء المارة في المحلول وكمية المواد المتكونة عند الاقطاب وهي كما يلي:
- القانون الأول لفاراداي
تتناسب كتلة المواد المتكونة عند أي قطب اثناء عملية التحليل الكهربي تناسباً طردياً مع كمية الكهرباء المارة في المحلول أو المصهور.
- القانون الثاني لفاراداي
عند مرور كمية معينة من الكهرباء فإن كمية المادة يطرأ عليها تغير تتناسب مع وزنها المكافيء.
توضيح قوانين فاراداي
- لناخذ المثال التالي:
Na+ (1) + le- = Na (s)
(الوزن الذري للصوديوم = 23)
- نلاحظ أنه يتكون ذرة صوديوم عندما يكتسب أيون الصوديوم إلكترون واحد .
- وإذا كان لدينا مول من أيونات الصوديوم (عدد افوجادرو من أيونات الصوديوم) فإنه يكتسب مول من الإلكترونات ( عدد افوجادرو من الإلكترونات ) ليترسب مول من ذرات الصوديوم (عدد افوجادرو من ذرات الصوديوم ) ووزن هذا المول من الصوديوم (23g).

- أي أن مولين من الإلكترونات ترسب مولين من الصوديوم (46g) ، وهكذا.
- أي أن كمية المادة المتكونة تعتمد على عدد مولات الإلكترونات أي كمية الكهرباء المارة في خلية التحليل الكهربي.
وقد تم الاتفاق على أن كمية الكهرباء اللازمة للحصول على مول من الإلكترونات تسمي فاراداي .
تعريف الفاراداي
- تعريف الفاراداي هو كمية الكهرباء التي شحنتها تعادل شحنة مول واحد من الإلكترونات
- ۱ فارادای = شحنة مول من الإلكترونات
- وحيث أن شحنة الالأكترون الواحد تساوي 19-10 × 6.023
- أي ان واحد فاراداي يساوي:
1Faraday = 1.6 × 10-19 x 6.023 × 1023 = 96368 coulomb
- ملاحظة : للتقريب سوف نستخدم قيمة فاراداي في 96500coulomb لتسهيل الحسابات.
القانون العام للتحليل الكهربي
- ينص القانون العام للتحليل الكهربي على أن:
عند إمرار (96500coulomb) خلال محلول او مصهور فإن ذلك يؤدي إلى ذوبان أو تصاعد أو ترسيب وزن مكافى جرامي من المادة عند أحد الأقطاب.

EM = الوزن المكافي الجرامي
M = وزن مول من المادة (الوزن الجزيئي أو الوزن الذري للمادة)
z = التغير في عدد الأكسدة (عدد الإلكترونات المفقودة أو المكتسبة أو تكافؤ العنصر)
مسائل محلولة على قوانين فاراداي
مثال (1): أوجد الوزن المكافىء لما يلي:
(۱) الفضة Ag+ + le- → Ag
(۲) النحاس Cu++ + 2e- → Cu
( الأوزان الذربة : 63.5 = Ag = 107.9 , Cu)
الحل:
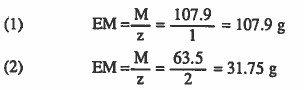
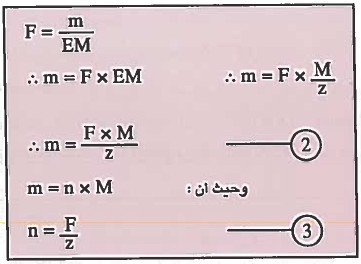
F = كمية الكهرباء بالفاراداي
EM = الوزن المكافىء الجرامي
n = عدد المولات
z = التغير في عدد الأكسدة ( عدد الإلكترونات المفقودة أو المكتسبة أو تكافؤ العنصر )
M = الوزن الجزيئي
m = وزن المادة بالجرام
مثال (2): أوجد كتلة النحاس المترسبة عند مرور (3Faraday):
Cu++ + 2e- → Cu
الوزن الذري : 63.5 = Cu
الحل:
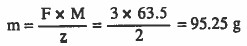
مثال (3): أوجد كمية الكهرباء بالفاراداي اللازمة لترسيب 32.7g من الخارصين علماً بان الوزن الذري: 65.4 = Zn
Zn++ + 2e- → Zn
الحل:
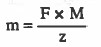
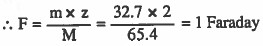
مثال (4): مررت شحنة كهربية مقدارها 0.1Faraday خلال خلية تحليل كهربي تحتوي على مصهور كلوريد البوتاسيوم KCl ، فما عدد مولات البوتاسيوم والكلور؟
الحل:
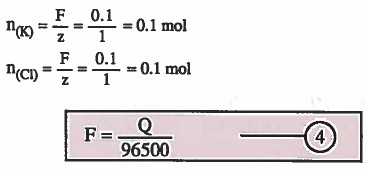
F = كمية الكهرباء بوحدة الفاراداي
Q = كمية الكهرباء بوحدة الكولوم
96500 = ثابت فاراداي
مثال (5): كم فاراداي في 482500Coulomb ؟
الحل:
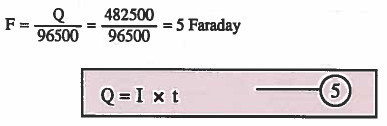
Q = كمية الكهرباء بوحدة الكولوم (coulomb)
I = شدة التيار بوحدة أمبير (A)
t = الزمن بوحدة الثانية (s)