تحضير هاليدات الألكيل من الكحولات
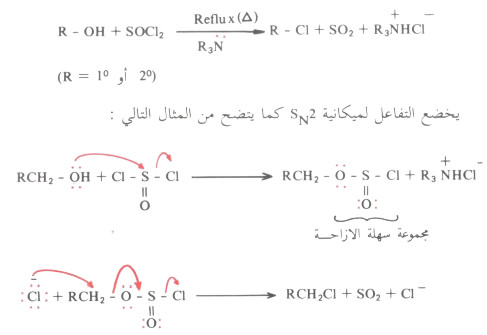
- سبق وأن عرفنا أنه يمكن أن نحصل على هاليد الألكيل من تفاعل الكحولات مع HX أو PX3 أو SOCl2.
طرق تحضير الهاليدات العضوية
- والآن وبعد معرفة ميكانيكة كل من تفاعل SN1 وتفاعل SN2 فإننا سنقوم بدراسة ميكانيكة تفاعل الكحولات هذه كل على حدة.
(1) تفاعل الكحولات مع HX
R - OH + HX → R - X + H2O
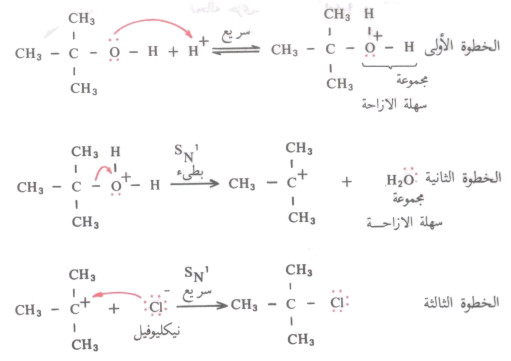
- تتفاعل الكحولات ماعدا الأولية (ويكون ترتيب نشاطها تجاه التفاعل النحو التالي: Benzy Allyl > 2o< 1o < 3o) عن طريق ميكانية SN1 وذلك بعد أضافة البروتون إلى الكحول ليسهل إزاحة المجموعة المزاحة (تصبح H2O بدل OH-)، لأنه كلما كانت المجموعة المزاحة أكثر ثباتاً كلما سهل إزاحتها
- ونجد أن جزىء H2O، وهو متعادل أكثر ثباتاً بكثير من OH- الذي يكون على شكل أنيون. ولنأخذ تفاعل كحول بيوتيل الثالثي مع HCl كمثال لتوضيح ميكانيكة هذا النوع من التفاعلات.
- أما بالنسبة للكحولات الأولية فتتفاعل عن طريق SN2 حيث أن الحمض في هذه الحالة يعمل على إضعاف الرابطة بين الكربون والأكسجين بحيث يسهل المهمة على أيون الهاليد أن يزيح جزىء الماء (والماء كما أشرنا مجموعة مزاحة أسهل من OH-).
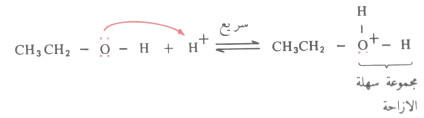
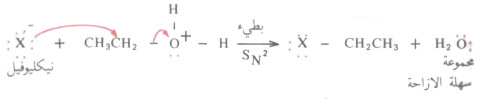
- لذلك فإن الكحولات الأولية تخضع في هذا التفاعل لتحول موضعي على عكس الكحولات الثانوية والثالثية التي يتم تفاعلها عن طريق تكوين أيون الكربونيوم (SN1).
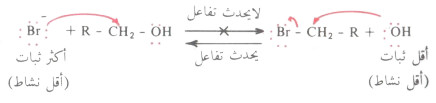
- ولكي يستطيع الكاشف النيكليوفيلي أن يزيح المجموعة المزاحة يجب أن يكون أقوى منها، بمعنى آخر يجب أن يكون النيكليوفيل أكثر نشاطاً (أقل ثباتاً) من المجموعة المزاحة>
- وكقاعدة عامة كلما زاد حجم الأيون وكلما زادت سالبيته الكهربية كلما زاد ثباته>
- كما أن النيكليوفيل أو المجموعة المزاحة المتعادلة (مثل الماء) أكثر ثباتاً من التي تكون على شكل أيون (مثل OH- أو X-) .
- لذلك نجد أن أيون الهاليد أكثر ثباتاً من أيون الهيدروكسيد وبذلك يمكن أن يحل محله إلا أنه عند تحويل أيون الهيدروكسيد إلى جزىء ماء حيث يسهل عندئذ إزاحته بواسطة أيون الهاليد. أما أيون الهيدروكسيد فإنه باستطاعته أن يحل محل أيون الهاليد.
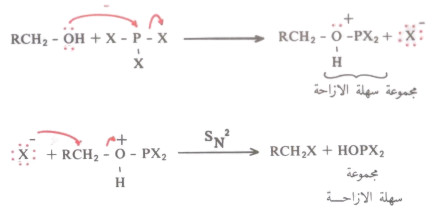
(2) تفاعل الكحولات مع PX3
3R - OH + PX3 → 3R - X + H3PO3
X = Br , I ) (R = 1o , 2o ))
- يخضع هذا التفاعل لميكانيكية SN2 ، حيث أنه لا يتكون أيون الكربونيوم كما في حالة SN1 ولذلك لا يحدث تحول موضعي
- ويتفاعل الكحول في الخطوة الأولى مع PX3 ليكون مجموعة مزاحة سهلة ومن ثم يتمكن أيون الهاليد من إزاحتها وبالتالي تكوين هاليد الألكيل.
(3) تفاعل الكحولات مع SOCl2