تفاعلات الاستبدال النيكلوفيلية في الأحماض الكربوكسيلية
- تفاعلات الاستبدال النيكلوفيلية هي أهم التفاعلات التي تقوم بها الأحماض الكربوكسيلية.
- وفي هذه التفاعلات يهاجم الكاشف النيكلوفيلي ذرة كربون مجموعة الكربونيل التي تأخذ شحنة موجبة جزئية (C+δ - O-δ) نظراً لفارق السالبية الكهربية بين ذرة الكربون وذرة الأكسجين.
- ويتم هذا الهجوم في وجود الأحماض المعدنية كعوامل مساعدة لأن إضافة بروتون الحمض يؤدي إلى تكوين رابطة هيدروجينية على ذرة أكسجين مجموعة الكربونيل، وهذا يزيد من قابلية ذرة كربون هذه المجموعة للهجوم النيكلوفيلي.
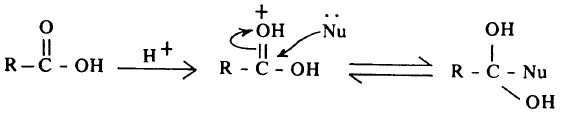
ويتبع ذلك انفصام رابطة C-O وفقدان بروتون ومن ثم يتكون ناتج الهجوم النيكلوفيلي.
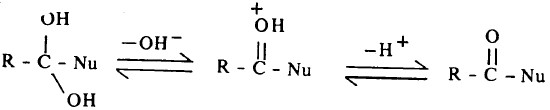
- وتعرف مجموعة (-R-C=O) بمجموعة الأسيل (acyl).
- وإذا ما كان (Nu) مجموعة الكوكسي (OR) أو ذرة هالوجين أو مجموعة أمينية أو مجموعة کربوکسيليت (RCOO) فإن هذه المشتقات تعرف في مجموعها بمشتقات الأحماض الكربوكسيلية.
- وتشترك هذه المشتقات مع الأحماض في وجود مجموعة الأسيل، وعليه فإنها تقوم بتفاعلات مشابهة.
- ونورد الآن أمثلة على تفاعلات الاستبدال النيكلوفيلية للأحماض الكربوكسيلية.
(1) تكوين الأسترات
- تتفاعل الحموض الكربوكسيلية مع الكحولات ويتكون مركبات الأسترات Esters وتعرف العملية في حد ذاتها بالأسترة Esterification.
- ويحفز تفاعل الأسترة هذا بالأحماض المعدنية القوية ويتم أيضاً في غياب الأحماض ولكن ببطء.
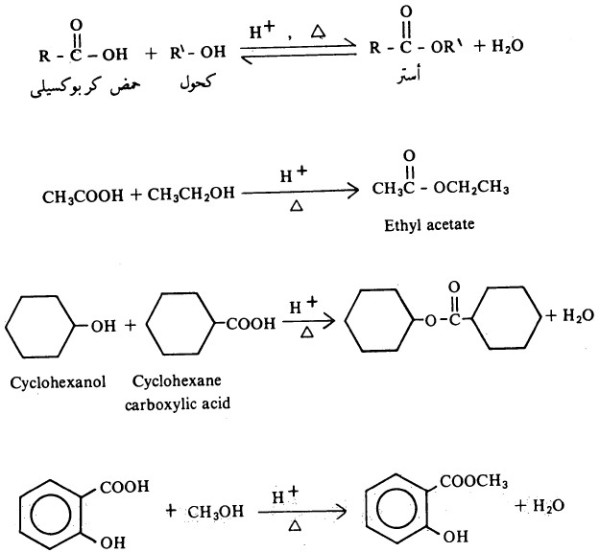
- وتفاعل تكوين الأستر تفاعل عكسي أي أن الأستر يتحلل مائياً إلى الحمض. ومن الأدلة التي تشير إلى الطبيعة العكسية لهذا التفاعل هو إجراء التفاعل بتراكيز مختلفة من المواد المتفاعلة.
- فعلى سبيل المثال إذا ما استخدم 5 مولات من كحول الايثل ومول واحد من حمض الخل فإن مردود الاستر هو %96 مقارنة بمردود من هذا الاستر لا يتجاوز ٦٥٪ إذا ما أجريت التجربة باستخدام مول واحد من الكحول والحمض.
- ونتيجة التجربة هذه تنطبق ومبدأ لوشاتليه الذي يقضي بتأثير التركيز على الاتزان وعليه فإن هذا التفاعل يتم في وجود الزيادة من الكحول، فضلاً عن أنه يخدم كمذيب في التفاعل.
- هناك تساؤل عن النوعية التي يتم بها تكسير الروابط في كل من الحمض والكحول حيث يوجد احتمالان:

- ولقد بقيت الإجابة على هذا التساؤل غير معروفة لفترة من الزمن أصبح استخدام نظائر الأكسجين لدى الكيميائي أمراً ميسوراً.
- فكما ثبت من التجربة أن تشكل الاستر المثيلي لحمض بنزويك يحدث وفقاً لتكسير الروابط كما هو موضح بالمعادلة التالية:
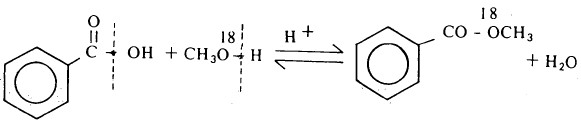
حيث ثبت عملياً أنه في تفاعل حمض بنزويك من الكحول الميثلي المرقم بالأكسجين ذي الوزن الذري ١٨ (180) تظهر ذرة الأكسجين المرقمة في الاستر المتكون من التفاعل.
ويتم تفاعل الأسترة وفقاً للميكانية التالية:
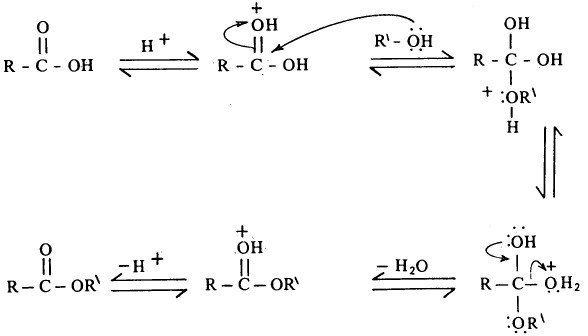
وتلعب العوائق الفراغية دوراً هاماً في عملية الأسترة إذ تتم ببطء، ويمكن أن يتضح ذلك من السرعة النسبية لعملية الأسترة المثيلية للأحماض الثلاثة التالية:

- هذا وقد لا تتم الأسترة إطلاقاً في بعض الأحيان عند وجود مجموعات كبيرة حول مركز التفاعل، فمثلاً لا يمكن أسترة الحمضين التاليين عند معاملة أيهما بالكحول في وسط حمضي.
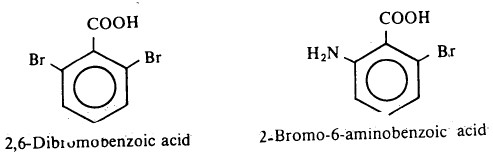
- ولنفس الأسباب (العوائق الفراغية) فإن الأستر الميثلي أو الأيثلي لأي من الحمضين السابقين لا يتحلل بمحاليل الأحماض المائية إلى الحمض الكربوكسيلي المطابق وعليه لابد من إتباع طرق خاصة في کلتی الحالتين.
(ب) تكوين هاليدات الحموض
تتفاعل الأحماض الكربوكسيلية مع هاليدات الفوسفور، بنفس الطريقة التي تتفاعل بها مع الكحولات، وتحل ذرة الهاليد محل مجموعة OH- ويتكون هاليد الحمض.
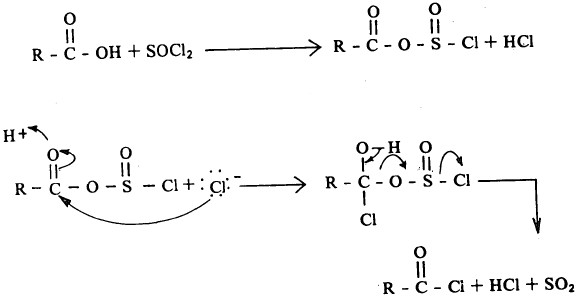
من هذا ويمكن الحصول على كلوريد الحمض الكربوكسيلي تفاعل الحمض مع كلوريد ثيونيل كما يتضح من المعادلة التالية:
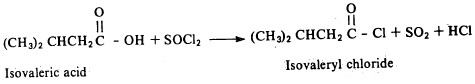
وهذه الطريقة هي الأكثر شيوعاً في تحضير كلوريدات الحموض، فهي بدون شك تؤدي إلى كلوريد حمض على درجة كبيرة من النقاوة لأن النواتج الأخرى هي غازات.
- أما ميكانيكبة هذا التفاعل فغير معروفة إلا أن أحد الاحتمالات المعقولة هو الذي يتم وفقاً للمعادلتين التاليتين: