تجربة تحضير الإيثيلين Ethylene
- ضع في أنبوب اختبار (a) كما بالشكل التالي (8) قطرات من حمض الكبريتيك المركز، و 4 قطرات من الكحول الإيثيلي وعدة حبيبات من Al2O3 من حيث هو وسيط.
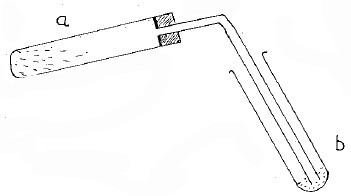
- أغلق أنبوب الاختبار بسدادة يخترقها أنبوب لخروج الغاز.
تجارب لتوضيح خواص الإيثيلين
(1) اغمس نهاية توصيل الغاز في أنبوب اختبار (b) تحتوى على قطرات من ماء البروم المشبع وسخن أنبوب الاختبار (a) على لهب. وتأكد من زوال لون ماء البروم زوالاً سريعاً.
(2) ارفع رفعاً سريعاً أنبوب توصيل الغاز من الأنبوب الحاوي ماء البروم واغمسه مرة أخرى في أنبوب اختبار (b) تحتوي على قطرة من محلول KMnO4 تركيز 0.1N و5 قطرات من الماء.
استمر في تسخين الأنبوب ، ولاحظ خلال ذلك الزول السريع للون برمنجات البوتاسيوم الوردي.
(3) أبعد الأنبوب (b) وقرب تقريباً سريعاً عود ثقاب مشتعل من فتحة أنبوب خروج الغاز. وتأكد من اشتعال الأيثيلين بلهب مضيء.
المعادلات الكيميائية لتحضير الإيثيلين
- لنتأمل الآن التفاعلات المشروحة سابقاً.
- عند تفاعل الكحول الإيثيلي مع حمض الكبريتيك المركز تخرج في البداية جزيئة ماء وتتكون كبريتات الأثيل الحامضية.
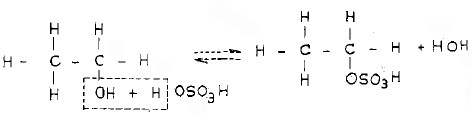
- وعند تسخين الأخيرة يقوم الجزء الحمضي منها بانتزاع ذرة الهيدروجين المرتبطة بذرة الكربون المجاورة. ونتيجة لذلك يتكون حمض الكبريتيك مرة أخرى وينطلق غاز الإيثيلين (هيدركربون غير مشبع).
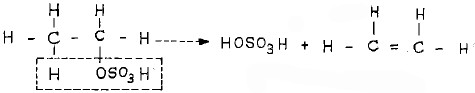
خواص الإيثيلين
- خلافاً للهيدروكربونات المشبعة من طائفة الميثان ذات الصيغة العامة 2+CnH2n فإن الهيدروكربونات من طائفة الإيثيلين ذات الصيغة العامة CnH2n تحتوي على ذرات كربونية عددها أقل بذرتين من طائفة الميثان، ولذلك فهي تعد مركبات غير مشبعة.
تفاعل الإيثيلين مع ماء البروم
- ووفقاً للتصورات الألكترونية الحديثة فإن الرابطة الثنائية تتألف من رابطة ثابتة (σ) وأخرى غير ثابتة (π) و تتحطم تحطماً سهلاً وتجرى عندئذ تفاعلات انضمام العناصر المختلفة كالبروم والأكسجين.
- وعند تفاعل الإيثيلين مع البروم يتكون ثنائي بروم إيثان كما بالمعادلة الآتية:
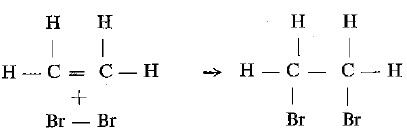
- ويمكن التأكد من سهولة انضمام البروم انضماماً سريعاً وزوال لون ماء البروم الأصفر .
تفاعل الإيثيلين مع برمنجات البوتاسيوم
- وبصورة مشابهة يحصل انضمام الأكسجين عند استعمال برمنجنات البوتاسيوم.
- ففي وسط مائي تنضم بالاضافه إلى الأكسجين أيضاً جزيئة ماء ويتكون بنتيجة ذلك كحول ثنائي الهيدروجين - إيثلين جليكول.
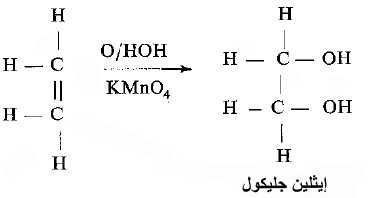
- ومن الطبيعي أن يحصل هذا أيضاً تفكك لبرمنجنات البوتاسيوم يؤدي إلى زوال لونها الوردي ويدعى هذا التفاعل باختبار باير للكشف عن الرابطة الثنائية.
ملاحظات هامة عن التجربة
- عند تسخين مزيج الكحول وحمض الكبريتيك المركز دون وسيط يلاحظ عادة اسوداد المزيج نتيجة لتفحم المادة العضوية.
- وعندئذ يحصل اختزال لحمض الكبريتيك بفعل الكربون المتكون إلى حمض الكبريتوز.
2H2SO4 + C → 2 H2SO3 + CO2
- ويتفكك حمض الكبريتوز المتكون معطياً ثاني أكسيد الكبريت والماء .
- إن ثاني أكسيد الكبريت يمنع اشتعال الإيثيلين أولاً كما أنه يمنع يستطيع ثانياً إزالة لون برمنجنات البوتاسيوم الوردي.
- ولهذا فإنه عند تحضير الإيثيلين يمرر الغاز المنطلق عادة في محلول قلوي لتنقيته من SO2.
- وأما عند استعمال A12O3 من حيث هو مادة وسيطة فلا يحصل للمزيج تفحم ولا يتكون SO2.