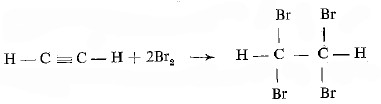تحضير الأسيتيلين Acetylene
- ضع في أنبوب اختبار (a) كما بالشكل التالي قطعة صغيرة من كربيد الكالسيوم CaC2.
- ثم أضف إليها قطرتين من الماء فيبدأ غاز الأسيتيلين بالانطلاق انطلاقاً سريعاً.
- لاحظ الرائحة المميزة للأسيتيلين التجاري والناتجة عن وجود شوائب سامة للأسيتيلين (مثل هيدريد الفوسفور PH3). أما الأسيتيلين النقي كيميائياً فليس له رائحة.
(1) قرب عود ثقاب من فتحة الأنبوب (a) وتأكد من أن الأسيتيلين يشتعل بلهب مضيء يرافقه هباب الفحم.
- في الحقيقة إذا تأملنا النسبة المئوية للكربون في جزيئة الميثان CH4 أو الإيثان C2H6 وفي جزيئة الأسيتيلين C2H2 أصبح واضحاً لدينا لماذا يشتعل الميثان والإيثان بلهب غير مضيء في حين يشتعل الأسيتيلين في الشروط العادية بلهب مضئ يرافقه هباب الفحم.
(2) ثم أغلق بسرعة الأنبوب (a) بسدادة مجهزة بأنبوب لخروج الغاز واغمر نهاية الأخير في أنبوب يحتوي على قطرة من برمنجات البوتاسيوم KMnO4 تركيز 0.1N و 5 قطرات من الماء. ولاحظ زوال لون المحلول الوردي.
(3) أضف إلى الأنبوب (a) التى تحتوى على CaC2 قطرتين أخريين من الماء ، واغمر نهاية أنبوب خروج الغاز في أنبوب اختبار (C) تحتوي على 5 قطرات من ماء البروم. ولاحظ زوال لون ماء البروم التدريجي.
(4) وقبل توقف انطلاق غاز الأسيتيلين أدخل في فتحة الأنبوب (a) (التى تحتوى على كربيد الكالسيوم) ورقة مبللة بمحلول كلوريد النحاس النشادري فيلاحظ لون بني محمر هو لون أسيتيليد النحاس الأحادي (Cu - C ≡ C - Cu)
(5) بعد انتهاء انطلاق الأسيتيلين أضف إلى الأنبوب (a) قطرة من محلول كحولي للفينول فثالين فيتلون المزيج بلون أحمر فاتح.
معادلة تفاعل تحضير الأسيتيلين
- عند تأثير الماء في كربيد الكالسيوم يحدث تفاعل طارد للحرارة يتكون في إثره الأسيتيلين الغازي وهيدروكسيد الكالسيوم كما بالتفاعل التالي:
CaC2 + H2O → C2H2 ↑+ Ca(OH)2
- يبرهن على وجود هيدروكسيد الكالسيوم بتلون المحلول الكحولي للقينول فثالين باللون الأحمر.
- أما وجود الأسيتيلين فيكشف عنه باشتعاله وبتكوين أسيتيليد النحاس الأحادي (Cu - C ≡ C - Cu)
- وفيما يلي معادلة تكون أسيتيليد النحاس الأحادي:
CuCl + H-C ≡ C-H + ClCu → Cu - C ≡ C - Cu + 2HCl
2HCl + 2NH3 → 2NH4Cl
- ولا يتكون أسيتيليد النحاس الأحادي إلا في وجود النشادر ولذلك يستعمل من الناحية العملية محلول كلوريد النحاسي النشادري.
- والنشادر ضروري لربط كلوريد الهيدروجين المتكون وهذا التفاعل حساس جداً ويستعمله الأطباء للكشف عن آثار الأسيتيلين في هواء عنابر المصانع التي تستعمل الأسيتيلين.
- ويجب التنبه إلى أسيتيليد النحاس الأحادي عند العمل به فهو خطر جداً عندما يكون جافاً إذ ينفجر عند تسخينه أو تعرضه للصدمات.
خواص الأسيتيلين
- ویعود سبب عدم الإشباع في الأسيتيلين ، كما تدل التصورات الالكترونية الحديثة ، إلى احتوائه على رابطة ثلاثية تتألف من رابطة تتألف من رابطة ثابتة (σ) ورابطتين غير ثابتتين (π) ويمكن الكشف عنهما بزوال لون برمنجنات البوتاسيوم الوردي أو لون ماء البروم الأصفر.
تفاعل الأسيتيلين مع برمنجانات البوتاسيوم
- في هذا التفاعل تصل أكسدة الأسيتيلين عند مكان انفصام الرابطة (π) حيث يتكون حمض الاكزاليك كمركب بنى يتفكك أيضاً إلى غاز ثاني أكسيد الكربون.
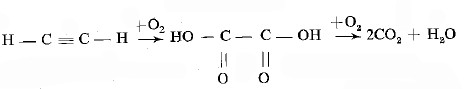
تفاعل الأسيتيلين مع ماء البروم
أما في هذه الحالة فيحصل انضمام البروم عند مكان انفصام الرابطة ، ويتكون بنتيجة ذلك رباعي بروم ايثان كما يلي: