معايرة السكروز Sucrose Titration
مبدأ التجربة
- تعتمد معايرة السكروز (سكر القصب) على خاصته الإرجاعية من حيث هو ( مختزل أو غير مختزل ) لكاشف فهلنج.
المواد اللازمة للتجربة
- محلول السكروز بالتركيز الذي يعد مجهولاً بالنسبة إلى الطلاب يبلغ تركيزه ( 1 أو 1.2 أو 1.5 أو 2 .... إلخ) % .
- محلول حمض الهيدروكلوريك المركز.
- محلول هيدروكسيد الصوديوم ذات التركيز البالغ %40.
- محلول فهلنغ (أ + ب) ( A - B )
خطوات التجربة
(1) يوضع في الدروق المخروطي 20 مل من محلول السكروز ويضاف إليه بكل حذر 1 مل من محلول حمض الهيدروكلوريك المركز. ثم يضاف (من 20 إلى 25) مل من الماء المقطر . ويوضع بعد ذلك الدروق المخروطي في حمام مائي حتى درجة الغليان . ويترك في الحمام المائي وهو يغلي لمدة نصف ساعة ثم يخرج الدروق المخروطي من الحمام ويبرد.
(2) نضيف إليه بعد التبريد 2 مل من محلول هيدروكسيد الصوديوم (يبلغ تركيزها %40). ثم ينقل المزيج الناتج إلى دورق حجمي (سعته 100 مل) ويكمل الحجم النهائي بواسطة الماء المقطر إلى الحجم 100مل.
- ثم يخض المحلول الناتج حتى يتم التجانس وأخيراً نملأ منه السحاحة (وذلك كالعادة أي بعد غسلها جيداً بالماء العادي والمقطر تم بقليل من المحلول السكري المتشكل).
- نضع في كأس بيكر مقدار 10 مل من محلول فهلنج ( 5 مل من محلول فهلنغج أ + 5 مل من محلول فهلنج ب) . ونضيف إليه من (20 إلى 30 مل) من الماء المقطر ثم نغلي المزيج ونثبته تحت السحاحة على شبك معدني مع استمرار الغليان
(3) ينقط على المحلول المغلي ، محلول السحاحة (أي محلول السكروز) قطرة فقطرة (مع ملاحظة عدم تحريك كأس البيكر) حتى الحصول على سائل عديم اللون وتشكل راسب أحمر في قعر الكأس ، هو (أكسيد النحاسيك CuO). وعندئذ نسجل الرقم الذي يدل على مقدار الاستهلاك من محلول السحاحة.
طريقة الحساب
- المطلوب : حساب تركيز محلول السكروز المعطى في التجربة.
- نتبع لذلك الطريقة التالية في الحساب كالتالي:
- لنفترض أن السحاحة استهلكت 10.1 مل من المحلول.
كل 10 مل من محلول فهلنج ترجع بوساطة 0.05 جم من السكر المنقلب.
وكل 10 مل من محلول فهلنج ترجع بوساطة 10.1 مل من محلول السكروز المنقلب.
أي أن كل 10.1 مل من محلول السكروز المنقلب تحوي 0.05 جم من السكر المنقلب.
و 100 مل من محلول السكروز المنقلب تحوي س جم من السكر المنقلب.
ومنه نجد أن 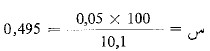 سكر منقلب موجودة في 100 مل من محلول السكر المخفف أو في 20 مل من محلول السكر المركز.
سكر منقلب موجودة في 100 مل من محلول السكر المخفف أو في 20 مل من محلول السكر المركز.
كل 20 مل من محلول السكر المنقلب تحوي 0,495 جم من السكر المنقلب .
و 100 مل من محلول السكر المنقلب تحوي ص جم من السكر المنقلب.
ومنه نجد أن 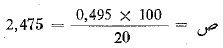 جم من السكر المنقلب.
جم من السكر المنقلب.
إذن كل 1 غ من السكر المنقلب يعادل 0.95 جم سكروز.
ف 2,475 جم من السكر المنقلب تعادل ع جم سكروز.
ومنه نجد أن 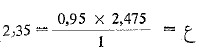 جم كمية السكروز.
جم كمية السكروز.