القانون المستخدم فى معايرة الأحماض والقواعد
- يستخدم القانون التالي فى حسابات معايرة الأحماض والقواعد
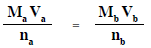
Ma = تركيز الحمض المستخدم (mol/L)
Va = حجم الحمض المستخدم فى المعايرة (ml)
na = عدد المولات من الحمض فى معادلة التفاعل المتزنة
Mb = تركيز القاعدة المستخدم (mol/L)
Vb = حجم القاعدة المستخدم فى المعايرة (ml)
nb = عدد المولات من القاعدة فى معادلة التفاعل المتزنة
حل المسألة:
2HCl + Ba(OH)2 → BaCl2 + 2H2O
من الجدول نحسب متوسط حجم الحمض المضاف وهو يساوى متوسط الحمض المضاف فى المعايرة (1) + المعايرة (2)
Va = (61.3 + 61.7 ) /2
Va = 61.5 ml
حمض الهيدروكلوريك HCl يكون:
Ma = 0.2 M
Va = 61.5 ml
na = 2
قاعدة هيدروكسيد الباريوم يكون:
Mb = ?? M
Vb = 0.02 L = 20 ml
nb = 1
وبالتعويض فى المعادلة أعلاه يكون:
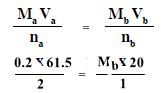
Mb = 0.3 M
تركيز هيدروكسيد الباريوم (القاعدة) هو 0.3 مولار (مول/لتر).