قاعدة هوند Hund's Rule
- اقترح العالم هوند عام 1927 ، في ضوء نتائج تجريبية توصل إليها وتنص على:
(أن الإلكترونات تملأ أفلاك تحت مستوى الطاقة الواحد ، كل إلكترون بمفرده باتجاه الغزل نفسه ، ثم تبدأ بالازدواج في الأفلاك تباعًا باتجاه غزل معاكس).
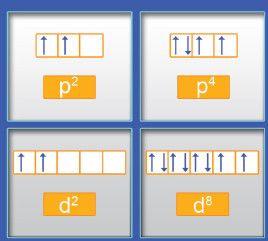
- عندما تشغل الإلكترونات أفلاكا متساوية في الطاقة (2pz ، 2py ، 2px) تتوزع أولاً بحيث يدخل إلكترون واحد في كل فلك إلى أن تمتلئ جميع الأفلاك بإلكترون واحد. ويكون الدوران المغزلي لهذه الإلكترونات في الاتجاه نفسه.
- على سبيل المثال، إذا وجدت ثلاثة إلكترونات تشغل أفلاكًا متساوية الطاقة، يكون ترتيبها كالتالي  ولا يكون
ولا يكون  .
.
- تضاف الإلكترونات التالية بعد ذلك لكل فلك بحيث يزدوج دورانها المغزلي مع الإلكترونات الأولى . وبالتالي ، يستطيع كل فلك أن يحتوي على إلكترونين مزدوجي الغزل.
- نظرًا إلى الترتيبات الإلكترونية لذرات 9 عناصر في الجدول التالي:
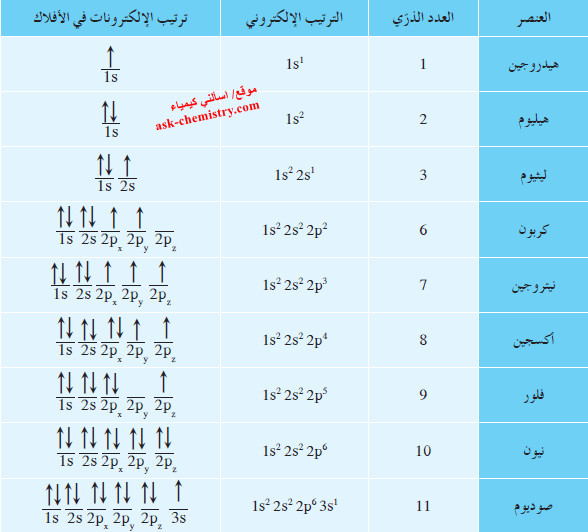
الترتيب الإلكتروني لذرة الأكسجين
- تجد أنّ ذرّة الأكسجين تحتوي على 8 إلكترونات حيث يأخذ الفلك الأقل طاقة 1s إلكترونين دورانهما المغزلي باتجاهين متضادين (مزدوجين).
- الفلك التالي (الأدنى طاقة) الذي يجب ملؤه هو 2s، ويأخذ أيضًا إلكترونين متضادي الغزل.
- ثمّ يدخل كلّ من الإلكترون الخامس والسادس والسابع الأفلاك الثلاثة المتساوية الطاقة لتحت مستوى الطاقة 2p ، بحيث يحتوي كلّ فلك على إلكترون واحد ويكون الدوران المغزلي لهذه الإلكترونات في الاتجاه نفسه.
- يدخل الإلكترون الثامن في أحد الأفلاك الثلاثة لتحت مستوى الطاقة 2p حيث يزدوج مع الإلكترون الموجود فيه، ويبقى الفلكان الآخران لتحت مستوى الطاقة 2p نصف ممتلئين بإلكترون واحد في كلّ منهما.
- لذلك لا يمكن للفلك الواحد أن يستوعب أكثر من إلكترونين فمثلاً:
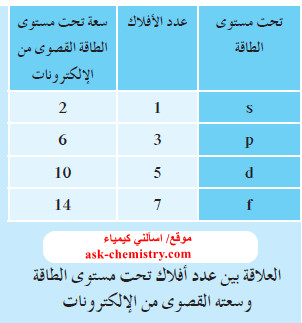
- يحتوي تحت مستوى الطاقة s على فلك واحد ، فتكون سعته القصوى إلكترونين.
- يحتوي تحت مستوى الطاقة p على ثلاثة أفلاك ، فتكون سعته القصوى 6 إلكترونات.
- يحتوي تحت مستوى الطاقة d على خمسة أفلاك ، فتكون سعته القصوى 10 إلكترونات.
- يحتوي تحت مستوى الطاقة f على سبعة أفلاك، فتكون سعته القصوى 14 إلكتروناً.