حل اسئلة مراجعة الدرس (1-1) نماذج الذرة – كيمياء الصف العاشر الفصل الأول - الكويت
السؤال (1): اذكر بالترتيب الزمني إسهامات كل من العلماء دالتون وطومسون وبور وروذرفورد لفهم الذرة.
الإجابة:
(أ) نموذج دالتون Dalton’s Model
- وضع دالتون أول نظرية عن تركيب الذرّة وافترض ما يلي:
- يتألّف العنصر من جسيمات صغيرة جدًّا ، لا تتجزّأ ، تسمّى الذرّات.
- تتشابه ذرّات العنصر الواحد في الخواص وتتساوى في الكتلة.
- تختلف ذرّات العناصر المختلفة في الخواص والكتل.
- تتفاعل ذرّات العناصر مع بعضها بنسب ثابتة لتكوين المركّبات.
(2) نموذج طومسون Thomson’s Model
- أجرى طومسون تجارب على التفريغ الكهربائي خلال الغازات داخل أنبوب زجاجي.
- وكان ما افترضه أنّ الذرّة عبارة عن كرة مصمتة تتوزّع على سطحها جسيمات سالبة الشحنة.
(3) نموذج رذرفورد Rutherford’s Model
- افترض رذرفورد الفروض التالية
- تشبه الذرّة المجموعة الشمسية (تدور الإلكترونات سالبة الشحنة حول نواة مركزية) .
- معظم الذرّة فراغ ، وحجم النواة صغير جدًّا بالنسبة إلى حجم الذرّة.
- تتركّز كتلة الذرّة في النواة (لأنّ كتلة الإلكترونات صغيرة جدًّا مقارنة بكتلة مكوّنات النواة من البروتونات والنيوترونات) .
- يوجد في الذرّة نوعان من الشحنات (شحنة موجبة في النواة تدعى بروتونات وشحنة سالبة حول النواة تدعى إلكترونات) .
- الذرّة متعادلة كهربائيًّا لأنّ عدد الشحنات الموجبة يساوي عدد الشحنات السالبة .
- تدور الإلكترونات حول النواة في مدارات خاصة.
- حين يدور الإلكترون حول النواة ، يخضع لقوتين الأولى قوة جذبها للإلكترونات والأخرى القوة المركزية الناشئة عن دوران الإلكترونات حول النواة.
(4) نموذج بور Bohr’s Model
- من خلال طيف الانبعاث الخطّي لذرّات الهيدروجين ، تمكّن بور من وضع نموذجه الذرّي ، وافترض ما يلي:
- يدور الإلكترون حول النواة في مدار ثابت.
- للذرّة عدد من المدارات، لكل منها نصف قطر ثابت وطاقة محددة.
- لا يشع الإلكترون الطاقة ولا يمتصها ما دام يدور في المسار نفسه حول النواة.
- يمكن للإلكترون أن ينتقل من مستوى طاقة إلى مستوى آخر ، إذا غيّر طاقته بما يتناسب مع طاقة المستوى الجديد.
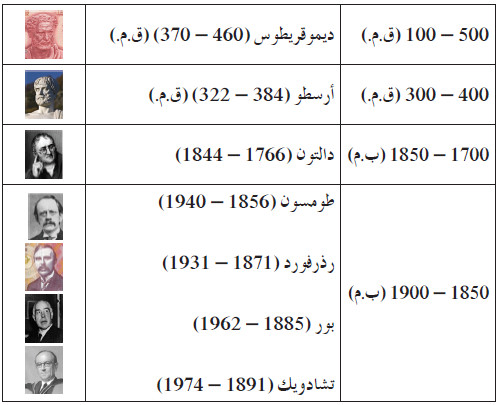
- الجدول التالي يوضح الترتب الزمنى لهذه الاسهامات:
السؤال (2): اشرح بصفة عامة النموذج الميكانيكي الموجي للذرة.
الإجابة:
- تنص ميكانيكا الكم على أن للإلكترونات مستويات طاقة محددة فقط. ويمكن تصور مواقع الإلكترونات في الأفلاك كسحابة من أشكال متنوعة عند مسافات مختلفة عن النواة.
السؤال (3): إذا كان عدد الكم الرئيسي يساوي 4:
أ- ما عدد تحت مستويات الطاقة في المستوى الرئيسي الرابع؟
ب- ما عدد أفلاك المستوى الرئيسي الرابع؟
ج- ما هو أكبر عدد من الإلكترونات الذي يمكن أن يستوعبه هذا المستوى؟
د- ما قيم أعداد الكم الثانوية في هذا المستوى؟
الإجابة:
(أ) 4 تحت مستوى طاقة
(ب) 16 فلك.
(جـ) 32 إلكترون.
(د) 3 , 2 , 1 , 0
السؤال (4): حدّد عدد الأفلاك في تحت مستويات الطاقة التالية:
أ- تحت مستوى الطاقة 3p
ب- تحت مستوى الطاقة 2s
ج- تحت مستوى الطاقة 4f
د- تحت مستوى الطاقة 4p
د- تحت مستوى الطاقة 3d
الإجابة:
أ- 3
ب- 1
ج- 7
د- 3
هـ - 5