حل اسئلة مراجعة الدرس (1-2): ترتيب الإلكترونات في الذرات – كيمياء الصف العاشر - الكويت؟
السؤال (1): اكتب الترتيب الإلكتروني لكل من الذرات التالية:
(أ) الليثيوم (3Li)
(ب) الفلور (9F)
(جـ) الروبيديوم (37Rb)
الحل:
Li3 : 1s2 2s1
F9 : 1s2 2s2 2p5
Rb37 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
السؤال (2): فسر لماذا تختلف الترتيبات الإلكترونية الفعلية للكروم (zaCr) والنحاس (zoCu) عن الترتيبات الإلكترونية المستنتجة
باستخدام مبدأ أوفباو
الإجابة:
- يمكن الحصول على الترتيبات الإلكترونية الصحيحة للعناصر وصولًا إلى عنصر الفاناديوم (العدد الذرّي = 23) وذلك باستخدام مخطط أوفباو لملء الأفلاك.
- إلّا أنّه عند الوصول إلى عنصري الكروم والنحاس، وإذا اتبعنا الطريقة نفسها لكتابة الترتيبات الإلكترونية لهما ، نحصل على
الترتيبات الإلكترونية غير الصحيحة التالية:

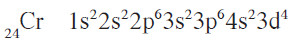
- أما الترتيب الفعلي والصحيح لهما فهو:
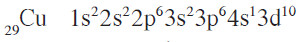
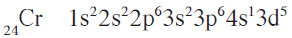
- نستنتج من هذه الترتيبات أنّ تحت مستوى الطاقة d يكون نصف ممتلئ في عنصر الكروم، ويكون ممتلئًا كليا في عنصر النحاس.
- تكون تحت مستويات الطاقة الممتلئة كليًّا أو النصف الممتلئة أكثر ثباتًا من تحت مستويات الطاقة الممتلئة جزئياً.
السؤال (3): رتب تحت مستويات الطاقة التالية تبعاً لنقصان الطاقة : 2p, 4s , 3s , 3d , 3p
الإجابة:
3d , 4s ,3p , 3s ,2p
السؤال (4): لماذا ينتقل إلكترون واحد في ذرة البوتاسيوم (19K) إلى مستوى الطاقة الرابع بدلاً من دخوله في مستوى الطاقة الثالث مع الإلكترونات الثمانية الموجودة أصلاً في هذا المستوى؟
الإجابة:
K19 : 1s2 2s2 2p6 3s2 3p6 4s1
- أصبح الفلكان 3s و 3p ممتلئين، ولذلك فإن الإلكترون الأخير سوف ينتقل إلى تحت مستوى الطاقة التالي وهو 4s ، لأنه أقل طاقة وأكثر استقراراً من 3d.