قاعدة الثمانية Octet Rule
- تنص قاعدة الثمانية على أن: الذرات تميل إلى بلوغ الترتيب الإلكتروني الخاص بالغاز النبيل خلال عملية تكوين المركبات.
- بمعنى آخر، إن الذرّة تميل إلى اكتساب أو فقدان إلكترونات إلى أن يصبح هناك ثمانية إلكترونات في غلاف التكافؤ.
- تذكر أن كل غاز نبيل (ما عدا الهيليوم يحتوي على ثمانية إلكترونات في مستوى طاقته الأعلى وأن الترتيب الإلكتروني الخاص به هو ، بشكل عام ، ns2 np2.
- على هذا الأساس، فإنّ تسمية قاعدة الثمانية تعود إلى الترتيب الإلكتروني الخارجي للغازات النبيلة.
- تميل ذرات العناصر الفلزية إلى فقدان إلكترونات التكافؤ الخاصة بها حيث تبقى ثمانية إلكترونات كاملة في مستوى الطاقة السابق الأقل طاقة.
- تميل ذرات بعض عناصر اللافلزات إلى اكتساب أو مشاركة إلكترونات عنصر لا فلزي آخر لتبلغ الترتيب الثماني.
- على الرغم من وجود بعض الحالات الشاذة، إلا أن قاعدة الثمانية تنطبق على معظم الذرّات في المركبات.
- عندما تفقد الذرّة إلكترونات التكافؤ فإنّها تصبح كاتيوناً.
- تتكون معظم الكاتيونات المعروفة نتيجة فقدان ذرات الفلزات لإلكترونات تكافؤها ، ومعظم هذه الفلزات لها من إلكترون تكافؤ واحد إلى ثلاثة إلكترونات تكافؤ من السهل فقدانها أو نزعها.
أمثلة على قاعدة الثمانية
(1) الصوديوم
- يُعتبر الصوديوم في المجموعة 1A نموذجًا لمثل هذه الفلزات.
- يساوي العدد الكلي للإلكترونات في ذرّة الصوديوم 11 إلكتروناً متضمّنا إلكترون تكافؤ واحدًا.
- عند تكوين مركب ما ، فإنّ ذرّة الصوديوم تفقد إلكترون تكافؤها تاركة ثمانية إلكترونات في غلاف الطاقة السابق.
- نظرًا لأنّ عدد البروتونات في نواة الصوديوم لا يزال يساوي 11 ينتج من فقدان وحدة واحدة من الشحنة السالبة أيون ذو شحنة موجبة (1+).
- يمكنك تمثيل عملية فقدان إلكترون أو تأين ذرة الصوديوم عبر كتابة الترتيب الإلكتروني الكامل للذرة والأيون المتكون:

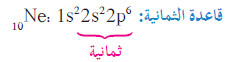
- يوضح الشكل التالي أنّ الترتيب الإلكتروني لأيون الصوديوم مماثل للغاز النبيل (النيون).
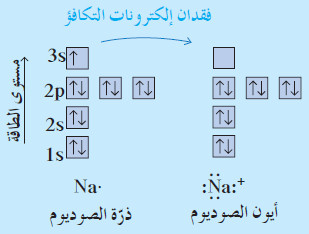

- توجد في أغلفة تكافؤ كلّ من أيون الصوديوم والنيون ثمانية إلكترونات.
- يمكن توضيح عملية التأين لذرّة الصوديوم ببساطة أكثر ، وذلك باستخدام الترتيب الإلكتروني النقطي كما يلي:

(2) الماغنسيوم
- ينتمي المغنيسيوم العدد الذري (12) إلى المجموعة 2A في الجدول الدوري، ولهذا يوجد إلكترونان في غلاف التكافؤ للذرّة الخاصة به.
- ولكي تصل هذه الذرة إلى الترتيب الإلكتروني للنيون فإنّها تفقد كلا الإلكترونين، ما يؤدي إلى تكون كاتيون المغنيسيوم الذي يحمل شحنة موجبة ضعف الشحنة التي يحملها كاتيون الصوديوم.

ملاحظات
- لاحظت مما درست أن كاتيونات عناصر المجموعة 1A شحنتها دائمًا (+1) وأن كاتيونات عناصر المجموعة 2A شحنتها (+2) .
- يمكن تفسير هذا الثبات في شحنة عناصر المجموعة الواحدة في ضوء فقدان ذرات الفلز لإلكترونات التكافؤ.
- تفقد الذرّات عددًا كافيًا من الإلكترونات كي تصل إلى الترتيب الإلكتروني للغاز النبيل.
- وعلى سبيل المثال، تحتوي كل عناصر المجموعة 2A على إلكترونين يؤدي فقدانهما إلى تكوّن كاتيونات شحنتها (+2).
- أما بالنسبة إلى الفلزات الانتقالية فقد تختلف شحنات الكاتيونات . مثلاً قد تفقد ذرّة الحديد إلكترونين أو ثلاثة إلكترونات.
- في الحالة الأولى، يتكون كاتيون حديدوز أو حديد (Ferrous) Fe2+ (II)، وفي الحالة الثانية يتكوّن كاتيون حديديك أو حديد (Ferric Fe3+ (III).

