الترتيبات الإلكترونية للأنيونات
- الأنيون هو ذرّة أو مجموعة من الذرّات التي تحمل شحنة سالبة.
- عندما تكتسب الذرة المتعادلة إلكترونات سالبة الشحنة، فإنّها تتحوّل إلى أنيون.
- نظرًا لتمتع ذرّات عناصر اللافلزات بأغلفة تكافؤ ممتلئة نسبياً، فإنه من الأسهل لها أن تكتسب إلكترونات لتكمل غلاف تكافؤها، وتبلغ الترتيب الإلكتروني للغاز النبيل.
(1) الكلور
- يندرج الكلور ضمن المجموعة 7A ويمتلئ غلاف تكافئه بسبعة إلكترونات ، ويكفي اكتساب إلكترون واحد حتى تصل ذرّة الكلور إلى الثمانية، وتتحوّل إلى أيون كلوريد مع شحنة أحادية سالبة.
- هكذا يتضح مما سبق أن ذرات الكلور تحتاج إلى إلكترون واحد يضاف إلى الإلكترونات السبعة الموجودة في غلاف تكافؤها لتصل إلى الترتيب الإلكتروني لأقرب غاز نبيل لها وهو الأرجون.
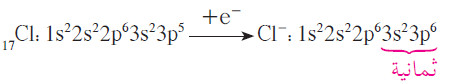
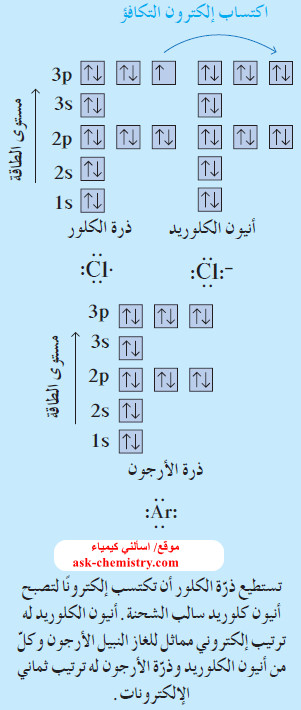
- يحتوي أنيون الكلوريد على ثمانية إلكترونات في أعلى غلاف طاقة له، ويصبح الترتيب الإلكتروني لهذا الأنيون مماثلاً للترتيب الإلكتروني لغاز الأرجون.
- يمكن أن تُستخدم أشكال الترتيبات الإلكترونية في كتابة معادلة توضح تكوّن أنيون الكلوريد من ذرّة الكلور.

- تسمى الأيونات التي تتكون عندما تكتسب ذرّات الكلور والهالوجينات الأخرى إلكترونات بأيونات الهاليد Halide ions.
- يحتوي غلاف تكافؤ جميع الهالوجينات على سبعة إلكترونات وهي تحتاج إلى اكتساب إلكترون واحد فقط لتبلغ الترتيب الإلكتروني للغاز النبيل الذي يليها. لذلك، فإنّ جميع أنيونات الهاليدات (-F- ، Cl- ،Br- ،I).
(2) الأكسجين
- الأكسجين هو مثال آخر حيث يندرج ضمن المجموعة 6A.
- تحتوي كل ذرّة أكسجين على ستة إلكترونات تكافؤ.
- تبلغ ذرة الأكسجين الترتيب الإلكتروني لأقرب غاز نبيل لها وهو النيون ، عبر اكتساب إلكترونين. ويصبح لأنيونات الأكسيد الناتجة منها شحنات مقدارها (-2) فتكتب على الشكل -O2.
- يعرض الجدول التالي بعض الأنيونات والكاتيونات المعروفة كما يلي:
