الأكسجين Oxygen
- تم تحضير الأكسجين في أغسطس سنة 1774 على يد الكيميائي الإنجليزي بريستلي.
- تم تحضيره بتسخين أكسيد الزئبقيك وجمع الغاز المتصاعد.
طرق تحضير الأكسجين
يحضر الأكسجين مخبرياً بعدة طرق مختلفة وأهمها:
(1) التفكك الحراري لبعض أكاسيد المعادن المنخفضة في السلسلة الكهروكيميائية
تكون معظم الأكاسيد المعدنية ثابتة تجاه الحرارة ، ولكن أكاسيد المعادن ذات الكمون المنخفض في سلسلة كمونات المساري، كالزئبق والفضة تكون غير ثابتة حرارياً، فتتفكك وتعطي الأكسجين.
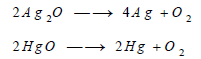
(2) تفكك فوق الأكاسيد
تتفكك بعض فوق الأكاسيد بالحرارة كما يتفكك بعضها الآخر في وجود الماء أو في وجود الأحماض :
(أ) التفكك بالحرارة
- حصل (شيل) على غاز الأكسجين بتسخين ثاني أكسيد المنجنيز عند درجة حرارة عالية:
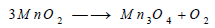
يتضح من هذه المعادلة أن ناتج التفاعل هو أيضا أكسيد يشبه أكسيد الحديدوز Fe3O4 ويتفكك فوق أكسيد الرصاص أيضا بالحرارة مكونا الليثارج Litharge
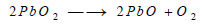
يمكن استخدام أكسيد الرصاص الأحمر Pb3O4 في هذا التفاعل، وذلك بتسخين الليثارج في الهواء 450 Co لتكوين الأكسيد الأحمر، ثم رفع درجة الحرارة إلى 550 Co لتفكيك هذا الأكسيد الأحمر إلى الليثاريج والأكسجين مرة أخري.
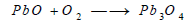
- ويتفكك فوق أكسيد الباريوم أيضا بالحرارة، ويتكون فوق أكسيد الباريوم بتسخين أكسيد الباريوم ثم ينحل بعد ذلك عند بلوغ درجة الحرارة إلى نحو 800 Co
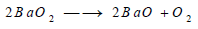
(ب) التفكك في وجود الأحماض
تتفكك بعض فوق الأكاسيد في وجود الأحماض ، ومثال ذلك تفكك فوق أكسيد المنجنيز في وجود حامض الكبريتيك طبقا للمعادلة التالية:
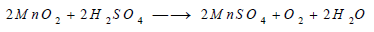
ولا يصلح استخدام حمض الهيدروكلوريك في هذا التفاعل، لأن ناتج التفاعل في هذه الحالة هو غاز الكلور.
(جـ) التفكك في وجود الماء
تتفاعل بعض فوق الأكاسيد مثل فوق أكسيد الصوديوم مع الماء وينطلق منها غاز الأكسجين:
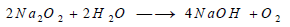
وقد استخدم هذا التفاعل مدة ما في تحديد الهواء في الأماكن المغلقة، فهو يطلق غاز الأكسجين في الهواء، ويمتص منه غاز ثاني أكسيد الكربون الناتج من التنفس بواسطة الأساس الناتج في التفاعل.
(3) تفكك الأملاح
- تتفكك كلورات البوتاسيوم عند تسخينها إلى درجة الانصهار، أي عند 270 Co هي تتحول إلى خليط من كلوريد البوتاسيوم، وفوق كلورات البوتاسيوم، وعند رفع درجة حرارة هذا الخليط إلى 400 Co تفقد فوق الكلورات الأكسجين وتتحول إلى الكلوريد.
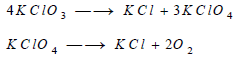
- تتفكك أيضا برمنغنات البوتاسيوم عند تسخينها تسخيناً هينا مكونة منغنات البوتاسيوم والأكسجين:
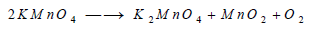
- أما ثاني كرومات البوتاسيوم فلا تنحل وحدها بالحرارة، ولكنها تتفاعل مع حمض الكبريتيك المركز وتطلق الأكسجين:
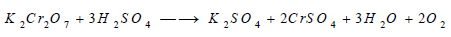
(4) التحليل الكهربي للماء
- يتحلل الماء كهربائيا بوجود كميات صغيرة من الأملاح أو الحموض أو الأسس فينطلق الأكسجين على المصعد والهيدروجين على المهبط، وتكون النواتج بدرجة نقاوة عالية:
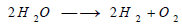
- يحضر الأكسجين صناعيا باستخدام التحليل الكهربائي للماء ومن الهواء بعد تمييعه.