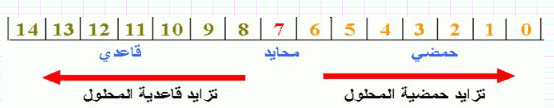
تصنيف المحاليل المائية حسب pH
صنفت المحاليل المائية حسب قيم pH إلى ثلاثة أصناف:
(أ) محاليل حمضية acidic solutions : ويكون 7> pH
(ب) محاليل متعادلة Natural Solution : ويكون pH=7
(جـ) محاليل قاعدية Basic Solution: ويكون 7<pH
ملاحظات
(1) يكون المحلول أكثر حامضية كلما صغرت pH ويكون المحلول أكثر قاعدية كلما كبرت قيمة pH
(2) عند تخفيف محلول حمضى ترتفع قيمة pH وتقل الحامضية وعند تخفيف محلول قاعدي تنخفض pH وتزداد القاعدية.
المحلول القاعدي Basic Solution
هو المحلول المائي الذي يحتوى على قاعدة Base وقد تم تعريف القواعد حسب ثلاث نظريات معروفة وكل منهما عرف القاعدة بطريقة مختلفة وهي :
(1) نظرية أرهينيوس Arrhenius theory
عرف القاعدة بأنها هي المادة التي عند ذوبانها فى الماء تطلق أيونات الهيدروكسيد السالبة (OH-) مثل: 2(Ca(OH
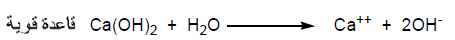
(2) نظرية برونستند – لوري Bronsted - Lowry theory
عرف الحمض على أنه المادة التى تعطي بروتوناً فى محلولها وأن القاعدة هي المادة التى تستقبل ذلك البروتون
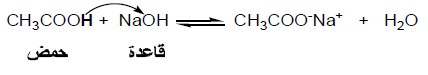
(3) نظرية لويس Lewis theory
عرف لويس القاعدة على أنها المادة التى لها المقدرة على منح زوج من الإلكترونات وتعتبر نيوكلوفيلات (nucleophile)
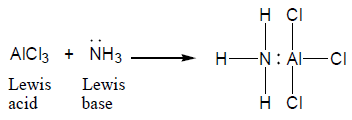
ملحوظة: المحاليل القاعدية تجعل ورقة عباد الشمس الحمراء زرقاء