المول The mole
- اتفق العلماء على استخدام اصطلاح المول في النظام الدولي القياسي (SI) للتعبير عن كميات المواد المستخدمة والناتجة من التفاعل الكيميائي.
- أول من أطلق اسم (مول) هو العالم فيلهلم أوستفالد عام 1894م وهي مشتقة من الكلمة الألمانية Mol وهو تكبير لكلمة Molecule أى جزئ.
- المول من المادة هو الكتلة الجزيئية لهذة المادة معبرة عنها بالجرامات.
مثال: أحسب مول واحد من كلوريد الكالسيوم
المول الواحد من كلوريد الكالسيوم CaCl2 = الكتلة الجزيئية لكلوريد الكالسيوم معبراً عنها بالجرامات
الكتلة الجزيئية لكلوريد الكالسيوم = ( 2 * كتلة أيون الكلوريد) + (1 * كتلة أيون الكالسيوم)
الكتلة الذرية للكلور = 35.5amu ، والكتلة الذرية للكالسيوم = 40amu
الكتلة الجزيئية لكلوريد الكالسيوم =
( 2 * 35.5) + (1 * 40) = 111amu
المول الواحد من كلوريد الكالسيوم CaCl2 يساوي 111g
- إذا استخدمت كتلة من غاز ثاني أكسيد الكربون CO2 مقدارها 44g فهذا يعني أنك تستخدم مولاً واحداً منه وإذا استخدمت كتلة منه مقدارها 22g فأنك تستخدم نصف مول منه.
- يمكن حساب عدد المولات من القانون التالي:
عدد المولات = كتلة المادة بالجرام / الكتلة الجزيئية لها
- تختلف كتلة المول من مادة لأخري ويرجع ذلك إلى اختلاف المواد عن بعضها في تركيبها الجزيئي وبالتالي اختلاف كتلتها الجزيئية حيث أن:
one mole of Cu = 63.5 g
one mole of CuSO4.5H2O = 249.5 g
- يختلف مول جزئ العنصر عن مول ذرة العنصر في الجزيئات ثنائية الذرة مثل الأكسجين O2 والنيتروجين N2 ، والهيدروجين H2 وغيرها.
- إذا كان الأكسجين فى صورة جزئيات فأن كتلة المول من جزئيات الأكسجين:
one mole of O2 = 2 x 16 = 32 g
- إذا كان الأكسجين فى صورة ذرات فأن كتلة المول من ذرات الأكسجين:
one mole of O = 1 x 16 = 16 g
- يختلف المول فى الحالة البخارية عن المول في الحالة الصلبة
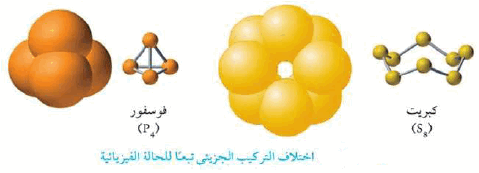
حيث هناك عناصر يختلف تركيبها الجزيئي تبعاً لحالتها الفيزيائية مثل الفوسفور في الحالة لبخارية يتكون الجزئ من اربعة ذرات (P4) ، وكذلك الكبريت في الحالة البخارية يوجد في صورة جزئ ثماني الذرات (S8) ، بينما في الحالة الصلبة فإن جزئ كل منهما عبارة عن ذرة واحدة، وبالتالي يختلف المول في الحالة البخارية عن المول فى الحالة الصلبة.
- المول الواحد من المادة يحتوى على عدد أفوجادرو من الذرات أى أن واحد مول من مادة ما يحتوى على 6.023 × 1023 ذرة من تلك المادة.
حساب الكميات الداخلة والناتجة فى التفاعل عن طريق عدد المولات
- من تفاعل الماغنسيوم والأكسجين كما يلي:
2 مول من الماغنسيوم تحتاج إلى 1 مول من الأكسجين لينتج 2 مول من أكسيد الماغنسيوم.
أى أن 48g من الماغنسيوم تحتاج إلى 32g من الأكسجين لينتج 80g من أكسيد الماغنسيوم.
علماً بأن الكتلة الذرية لكل من الأكسجين والماغنسيوم هي 24amu ، 16amu على الترتيب.
