مبدأ البناء التصاعدي Auf-bau principle
- كل مستوى طاقة يحتوي على عدد من مستويات الطاقة الفرعية التى تختلف عن بعضها اختلافاً طفيفاً فى الطاقة، لذا يكون الترتيب الحقيقي للطاقة فى الذرة حسب ترتيب مستويات الطاقة الفرعية.
- ينص مبدأ البناء التصاعدي على أنه:
"لابد للإلكترونات أن تملأ المستويات الفرعية ذات الطاقة المنخفضة أولاً ثم المستويات الفرعية ذات الطاقة الأعلي"
- تترتب المستويات الفرعية تصاعدياً كما هو موجود بالشكل التالي:

أهم خواص رسم أوفباو
(1) طاقة المستوىات الفرعية في المستوى الثانوي جميعها متساوية
حيث تجد أن المستوىات الفرعية الثلاثة في المستوى الثانوي 2p جميعها متساوية الطاقة.
(2) في الذرة المتعددة الإلكترونات تكون طاقة المستوىات الثانوية المختلفة ضمن مستوى الطاقة الرئيس الواحد مختلفة.
حيث تجد أن طاقة المستوىات الفرعية الثلاثة في المستوى الثانوي 2p أعلى من طاقة المستوى الفرعي 2s
(3) تسلسل زيادة طاقة المستوىات الثانوية ضمن مستوى الطاقة الرئيسي الواحد هو f,d,p,s.
فإذا كان n=4 فسيكون التسلسل لمستويات الطاقة الثانوية 4f,4d,4p,4s
(4) تستطيع مستويات الطاقة الثانوية لمستوى رئيسي أن تتداخل مع مستويات الطاقة الثانوية ضمن مستوى رئيسي آخر.
حيث تكون طاقة المستوى الفرعي فى المستوى الثانوي 4s أقل من طاقة المستويات الفرعية الخمسة في المستوى الثانوي 3d.
ويمكن تلخيص الفقرات السابقة فى الجدول التالي:

على الرغم من أن مبدأ أوفباو يصف التسلسل الذي تمتلئ فيه المستويات الفرعية بالألكترونات الإ أنه من المهم أن نعرف أن الذرات لا تبنى بإضافة إلكتروناً بعد الآخر.
كيف يمكن معرفة مستويات الطاقة الفرعية الأقل والأعلى فى الطاقة؟
- من خلال تطبيق قاعدة ( n+l) والتي تنص على أن طاقة الأغلفة الثانوية تزداد كلما ازدادت قيمة ( n+l) وإذا تساوت قيمة (n+l) لغلافين ثانويين أو أكثر فأقلها طاقة ما له اقل قيمة عددية لعدد الكم الرئيسي (n)
حيث (n) : عدد الكم الرئيسي ، (l) : عدد الكم الثانوي
- يمكنك استخدام الجدول التالي فى معرفة قيمة n , l
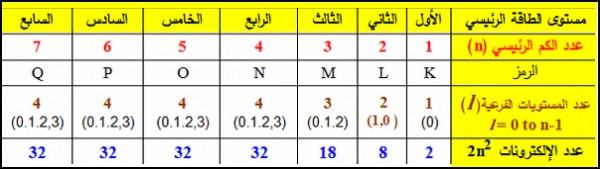
ويكون عدد الكم الثانوي (l) للأغلفة s,p,d,f كالتالي:

مثال (1): أيهما أكثر طاقة 3s أو 3P؟
- يتضح من خلال استخدام القاعدة (n+l)
3s = 3 + 0 = 3
3p = 3 + 1 = 4
وبما أن القيمة أكبر فى حالة 3p عنها فى حالة 3s فأن 3p أعلى فى الطاقة من 3s
أو بتعبير آخر الغلاف 3s يتقدم الغلاف 3p في سلسلة الأغلفة الثانوية أعلاه ويمتلئ بالألكترونات أولاً.
مثال (2): أيهما أكثر طاقة من بين الأغلفة (6s , 4d , 5p) حيث أن قيمة (n+L) لكل منها تساوي 6 ؟
بتطبيق القاعدة ( n+l) يكون:
6s = 6 + 0 = 6
5p = 5 + 1 = 6
4d = 4 + 2 = 6
- حسب ما جاء بالجزء الثاني من قاعدة (n+l) فإن طاقة المستويات الفرعية تترتب حسب عدد الكم الرئيسي (n) فأقلها طاقة أقلها فى عدد الكم الرئيسي.
- الغلاف (6s) هو أكثر هذه الأغلفة طاقة أو يمكن ترتيب هذه الأغلفة كما هو موضح بالشكل التالي:
