تهجين جزئ الإيثيلين CH2 = CH2 Ethylene
(1) يتم تهجين فلك (2s) مع فلكين (2p) في ذرة الكربون المثارة فتنتج (3) أفلاك متماثلة في الشكل والطاقة ويبقى الفلك (pz) في وضعه الأصلي قبل التهجين وتسمى الأفلاك المهجنة sp2 لأنها تكونت من تهجين فلك (s) وفلكين (p).
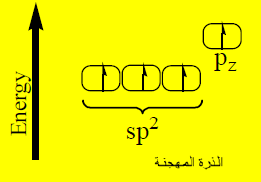
(2) يحدث تنافر بين الأفلاك المهجنة حتى تصل الزوايا بينها إلى 120o
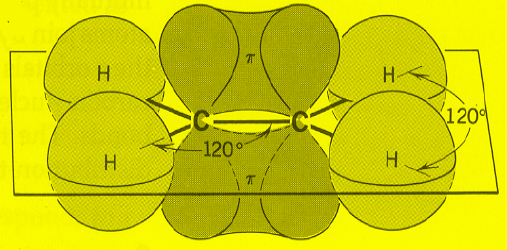
(3) التداخل في جزئ الإيثلين:
(أ) تداخل يؤدي إلى تكوين روابط سيجما (σ):
- تداخل أفلاك (sp2) من كل ذرة كربون مع أفلاك (1s) من كل ذرة هيدروجين ينتج عنه رابطة C-H
- تداخل بين أفلاك (sp2) من كل ذرة كربون ينتج عنه رابطة C-C
(ب) تداخل يؤدي إلى تكوين روابط باي (π):
نتيجة تداخل جانبي بين الفلك (pz) من ذرة كربون مع الفلك(pz) من ذرة الكربون الاخرى.
(4) عدد الروابط المتكونة في جزي الإيثلين = 6 روابط منها (5) روابط سيجما ورابطة واحدة فقط من النوع باي.
(5) من خلال دراسة تهجين جزئ الإيثلين نستنتج أن الشكل الهندسي له هو مثلث مسطح Planar triangle
ملاحظات هامة
(أ) الرابطة باي: (π) (Pi bond) هي رابطة تنشأ من التداخل الجانبي للأفلاك الذرية غير المهجنة أي تكون متوازية.
(ب) ان درجة تداخل الأفلاك الإلكترونية في رابطة سيجما (σ) أعلى من درجة التداخل في الرابطة باي (π) لهذا فأن الرابطة سيجما (σ) أقوى من الرابطة باي (π).