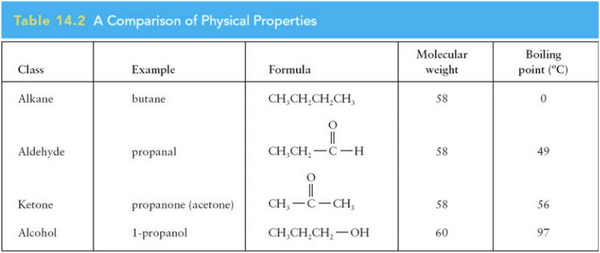
درجة غليان الألدهيدات والكيتونات
- تعلم أن الأكسجين أكثر كهروسالبية من الكربون، لذا تتوقع عدم انتظام في الكثافة الإلكترونية بينهما، وانحيازها نحو الأكسجين، وتكون بذلك مجموعة الكربونيل قطبية.
- أن قطبية مجموعة الكربونيل تجعل الألدهيدات والكيتونات مركبات عالية القطبية وهذه الخاصية تعمل على إنشاء قوى تجاذ ب بين الجزيئات أو ما يطلق عليه تجاذب بين الشحنة الجزئية السالبة على أكسجين مجموعة الكربونيل لجزيء والشحنة الجزئية الموجبة على كربون مجموعة الكربونيل لجزيء آخر.
- بسبب هذه القطبية تكون درجات غليان للألدهيدات والكيتونات أعلى من درجات غليان الهيدروكربونات والإيثرات المقابلة لها في الوزن الجزيئي.
- ولكنها أقل من درجات غليان الكحولات المقابلة لها في الوزن الجزيئي نظراً لعدم مقدرتها على تكوين روابط هيدروجينية بين جزيئاتها
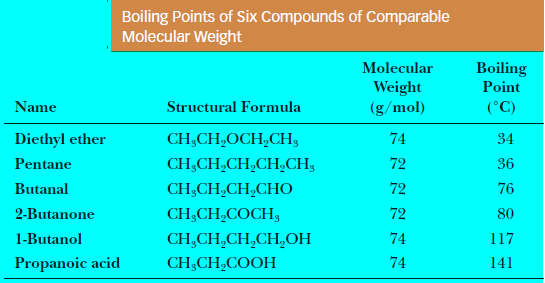
- الأمثلة التالية توضح قوة الروابط الهيدروجينية بالنسبة لقوة التجاذب القطبي من خلال قيم العزم القطبي لجزيئات مختلفة متقاربة في الوزن الجزيئي:
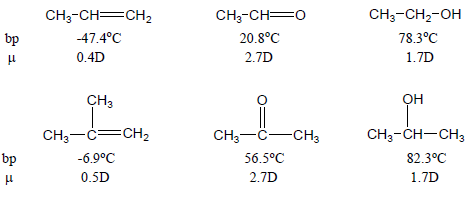
درجة غليان الكيتونات أعلى من الألدهيدات والتى لهما نفس الوزن الجزيئي
- الألدهيدات لا تكون روابط هيدروجينية لأن جزيئاتها لا تحتوى على ذرة هيدروجين مرتبطة مباشرة بذرة الأكسجين (هيدروجين حمضي) كذلك لا تكون الكيتونات روابط هيدروجينة بين جزيئاتها عكس ما يوجد فى الكحولات.
- لذلك لا تلعب الروابط الهيدروجينية هنا أى دور على عكس ماذكر فى كثير من المواقع.
- عملية الغليان لا تؤدي إلى كسر الرابطة C=O
- يتم تحديد نقاط الغليان من خلال المقدار النسبي للقوى بين الجزيئات relative magnitudes of the intermolecular forces
- درجة غليان الكيتونات أعلى من درجة غليان الألدهيدات التى لهما نفس الوزن الجزيئي وذلك لأن قيمة العزم القطبي dipole moment للكيتونات أعلى منها فى الألدهيدات.
- ارتفاع قيمة العزم القطبي يؤدى الى زيادة قوى التجاذب ثنائية القطب dipole-dipole attractions forces وزيادة قوى التشتت (قوى فاندرفال) بين الجزئيات (dispersion forces (Van der Waals forces وتزداد درجة الغليان.
- فنجد أن العزم القطبي للبروبانول(الأسيتون) = 2.91D وللبروبانال = 2.52D لذلك فأن قوى التجاذب ثنائية القطب بين الجزئيات وقوى التشتت (قوى فاندرفال) فى حالة الأسيتون أعلى منها فى حالة البروبانال.
- الشكل التالي يوضح درجة الغليان لألدهيد (بروبانال) والكيتون (البروبان) التى لهما نفس الوزن الجزيئي ونفس العدد من ذرات الكربون.
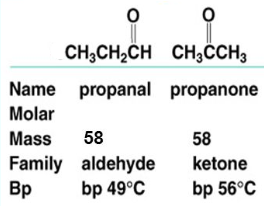
- الجدول التالي يوضح درجات الغليان للالكانات والألدهيدات والكيتونات والكحولات التى لهما نفس الوزن الجزيئي