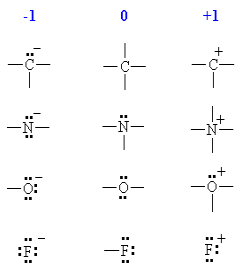الشحنة التقديرية Formal charges
- الشحنة التقديرية هي الشحنة المعينة للذرة في الجزيء ، على افتراض أن الإلكترونات الموجودة في جميع الروابط الكيميائية يتم تقاسمها بالتساوي بين الذرات ، بصرف النظر عن السالبية الكهربية.
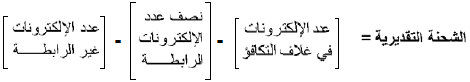
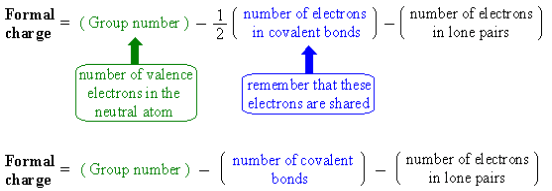
- يمكن حساب الشحنة الرسمية لأي ذرة في الجزيء بالمعادلة التالية:
أمثلة تدريبية
مثال(1): حساب الشحنة التقديرية على جزئ CH3NO2 Nitromethane
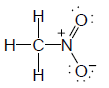
- تكون ذرة النيتروجين 4 روابط وليس 3 وبالتالي تحمل شحنة موجبة (1+).
- تكون أحدى ذرات الأكسجين رابطة أحادية وليست زوجية وتحمل شحنة سالبة (1-).
- يتم حساب الشحنة التقديرية على ذرة النيتروجين كما يلي :-
عدد إلكترونات التكافؤ = 5 ، وعدد الإلكترونات الرابطة = 8 ، وعدد الإلكترونات غير الرابطة = 0
formal charge = 5 - 8/2 - 0 = +1
- حساب الشحنة على ذرة الأكسجين :-
عدد إلكترونات التكافؤ = 6 ، وعدد إلكترونات الرابطة = 2 ، وعدد الإلكترونات غير الرابطة = 6
formal charge = 6 - 2/2 - 6 = -1
مثال(2): حساب الشحنة التقديرية على الكبريت والأكسجين في جزئ Dimethyl sulfoxide
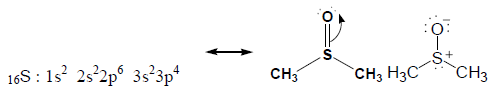
- حساب الشحنة التقديرية للكبريت
عدد إلكترونات التكافؤ = 6 ، وعدد إلكترونات الرابطة = 6 ، وعدد الإلكترونات غير الرابطة = 2
formal charge = 6 - 6/2 - 2 = +1
- حساب الشحنة التقديرية للأكسجين:
عدد إلكترونات التكافؤ = 6 ، وعدد إلكترونات الرابطة = 2 ، وعدد الإلكترونات غير الرابطة = 6
formal charge = 6 - 2/2 -6 = -1
مثال(3): حساب الشحنة التقديرية على آيون الأمونيوم NH4
- الشحنة التقديرية للهيدروجين:
عدد إلكترونات التكافؤ = 1 ، وعدد إلكترونات الرابطة = 2 ، وعدد الإلكترونات غير الرابطة = 0
formal charge = 1 - 2/2 - 0 = 0
- الشحنة التقديرية للنيتروجين:
عدد إلكترونات التكافؤ = 5 ، وعدد إلكترونات الرابطة = 8 ، وعدد الإلكترونات غير الرابطة = 0
formal charge = 5 - 8/2 - 0 = +1
- الشحنة التقدير الكلية للأيون:
F(4H) = 4 x 0 = 0
F(N) = +1 x 1 = +1
مجموع الشحنة للأيون = 1+
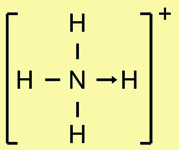
مثال(4): حساب الشحنة التقديرية على آيون النترات NO3
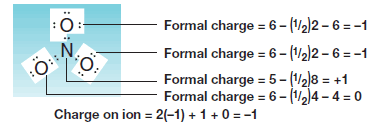
مثال(5): حساب الشحنة التقديرية على جزئ الماء
مثال(6): حساب الشحنة التقديرية على جزئ الأمونيا Ammonia NH3
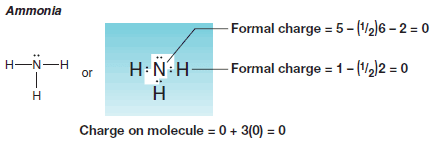
حساب الشحنات التقديرية لبعض التراكيب المألوفة
من السهل تذكر بعض التراكيب المألوفة بدلاً من حساب الشحنات التقديرية في كل مرة كما هو موضح في الشكل التالي: