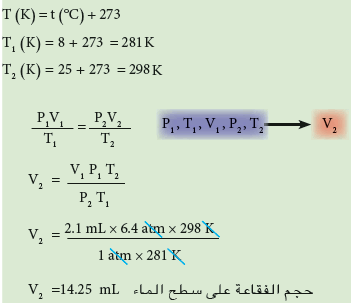القانون الموحد للغازات The Combined Gas Law
- من قانون بويل: PV = K1
- من قانون شارل: V / T = K2
- من قانون جاى لوساك: P / T = K3
حيث K1 , K2 , K3 ثوابت
من هذة القوانين الثلاثة يمكن أن يصاغ قانون موحد هو:
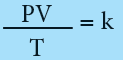
حيث K كمية ثابتة
- وفي حالة تغير ظروف الغاز (P1 , V1 , T1) الى حالته الثانية (P2 , V2 , T2) مع بقاء كميته ثابتة يمكن ان نكتب :
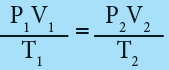
- يطلق على المعادلة السابقة القانون الموحد للغازات وهذا المعادلة تعتبر معادلة حالة Equation of state
استنباط القوانين الثلاثة للغازات من القانون الموحد
- إذا وجدت صعوبة في تذكّر قوانين الغازات السابقة منفردة ، يُمكِنك تذكّر قانون واحد يجمعها ، وهو القانون الموحَّد للغازات The Combined Gas Law ويُعبَّر عنه رياضيًّا بما يلي:
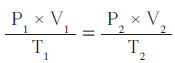
ويمكن استنباط جميع القوانين السابقة منفردة من هذا القانون الموحَّد ، وذلك بجعل أحد المتغيّرات الثلاثة (الضغط ، الحجم أو درجة الحرارة) ثابتًا.
(1) افترض أنّنا جعلنا درجة الحرارة ثابتة (T1 = T2) بإعادة ترتيب القانون الموحَّد للغازات لتصبح درجة الحرارة في الطرف نفسه من المعادلة ، وبالتالي يمكن اختصارها بما يلي:
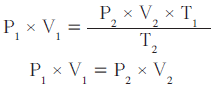
وكما ترى ، حصلت بذلك على قانون بويل .
(2) إذا جعلت الضغط ثابتًا P1 = P2 تتحوَّل المعادلة إلى قانون تشارلز
(3) وإذا كان الحجم ثابتًا V1 = V2 تتحوَّل المعادلة إلى قانون جاي - لوساك .
وكما هو الحال ، بالنسبة إلى كلّ من القوانين المنفردة ، فالقانون الموحَّد للغازات يبقى صالحًا فقط ما دامت كمّية الغاز لم تتغيَّر.
تمرين محلول
فقاعة هواء صغيرة حجمها 2.1ml أرتفعت من قاع بحيرة حيث الضغط 6.4atm ودرجة حرارة 8Co إلى سطح الماء حيث درجة الحرارة 25Co والضغط 1atm. أحسب حجم الفقاعة على سطح الماء.
الحل: